VODÍKOVÉ VAZBY
V ŠTRUKTÚRACH KOORDINAČNÝCH ZLÚČENÍN
Cu(II) S N─METYLDERIVÁTMI ETÁN─1,2─DIAMÍNU A TETRAFLUORIDOBORITANOVÝM ANIÓNOM
J. Haníková, J.
Černák
Univerzita P. J. Šafárika, Košice, Prírodovedecká
Fakulta, Katedra anorganickej chémie, Moyzesova 11, 041 54 Košice, SR
jaroslava.hanikova@student.upjs.sk,
juraj.cernak@upjs.sk
Štúdium vzťahu medzi magnetickými vlastnosťami a kryštálovou
štruktúrou je v súčasnosti atraktívnou oblasťou výskumu. Magnetické
vlastnosti meďnatých zlúčenín (S =
1/2) sú výrazne ovplyvnené priestorovým usporiadaním výmenných ciest. Zistilo
sa, že okrem kovalentných väzieb cesty magnetických výmenných interakcii môžu sledovať
aj interakcie typu vodíkovej väzby, respektíve π-π interakcie [1],
ktoré zabezpečujú vhodnú orientáciu magneticky aktívnych iónov v priestore [2].
Vodíkové väzby sú veľmi dobre preskúmané z geometrického aj
energetického hľadiska, je však málo poznatkov o ich schopnosti
sprostredkúvať výmenné interakcie. Táto úloha vodíkových väzieb bola potvrdená
vo viacerých prípadoch. Ako príklad zlúčeniny, v ktorej dochádza
k antiferomagnetickým interakciám medzi centrálnymi atómami Cu(II) len
prostredníctvom intermolekulových vodíkových väzieb, je možné uviesť [Cu(eo)3]SO4 (eo=
etán-2-diol) [3]. Vplyv vodíkových väzieb na magnetické vlastnosti bol
študovaný aj v prípade zlúčenín typu [Cu(L-L)2M(CN)4],
v ktorých L-L boli en =
etán-1,2-diamín, men
= N-metyl-etán–1,2–diamín, bmen = N, N΄–dimetyl–etán–1,2–diamín, dmen
= N, N΄–dimetyl–etán–1,2–diamín a ako
mostík medzi atómami medi vystupovali štvorcové tetrakyanidokomplexné anióny
[M(CN)4]2- (M= Ni, Pd, Pt) [4-6]. V posledne
menovaných zlúčeninách boli atómy medi premostené päťatómovým mostíkom -NC-M-CN-.
Výsledky štúdia ukázali, že medzi atómami medi v týchto zlúčeninách
existuje slabá antiferomagnetická interakcia a magnetická rozmernosť je
zvýšená výmennými interakciami pozdĺž vodíkových väzieb typu NH···N···HN [5, 6].
S cieľom skrátiť dĺžku kovalentného mostíka rozhodli sme sa nahradiť
päťatómový mostík tvorený tetrakyanidokomplexnými aniónmi trojatómovým mostíkom
na báze fluoridoaniónov, napr. BF4- alebo SiF62-.
Rešeršou z Cambridgeskej
kryštalografickej databázy (CSD, verzia koniec roka 2008) [7] bolo
nájdených 104 zlúčenín obsahujúcich atóm Cu(II) a tetrafluoridoboritanový
anión. Z nich 25 obsahovalo katión [Cu(L-L)2]2+,
v ktorom ligand L-L je en alebo jeho N-metyl deriváty. Nakoľko v literatúre chýbajú podľa našich
vedomostí detailné údaje o vodíkových väzbách typu XH···FBF3–
[8] bola v CSD taktiež vykonaná rešerš s
cieľom preskúmať geometrické parametre vodíkových väzieb typu O–H···F
a N–H···F. Rešeršou sa našlo 5475 vodíkových väzieb typu N–H···F a 3292 vodíkových väzieb typu O–H···F. Po obmedzení typu
akceptora na fluoridový atóm z tetrafluoridoboritanovej skupiny sa zistilo
existencia 526 vodíkových väzieb typu O–H···FBF3– a 919
prípadov vodíkových väzieb typu N–H···FBF3-. Prvým
sledovaným parametrom bola závislosť vzdialenosti medzi donorom, D
a akceptorom A vodíkovej väzby D···A od početnosti. Druhým parametrom bola
závislosť uhla D–H···A od početnosti. Zistili sme, že typické hodnoty väzbových
vzdialenosti D···A pre vodíkové väzby typu O–H···FBF3– sú
v rozsahu 2,6–3,0 Å s maximom pri 2,7 Å a vzdialenosti medzi
donorom a akceptorom pre vodíkové
väzby typu N−H···FBF3– sú v rozsahu 2,6–3,4 Å
s maximom pri 3,0 Å. Príslušné závislosti sú znázornené na Obr.
a)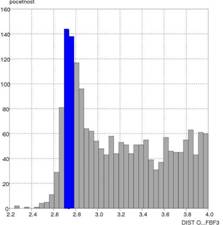 b)
b)
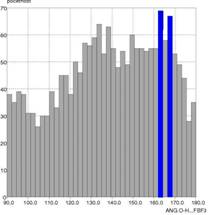
Obr. 1 Grafické
znázornenie závislosti početnosti od vzdialenosti O···F (a) a početnosti od hodnoty uhla
O–H···F (b) vo vodíkových väzbách typu OH···FBF3–.
a) 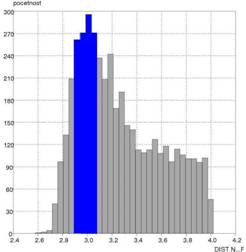 b)
b) 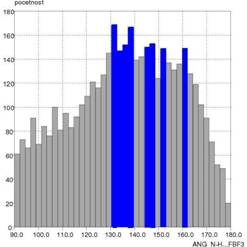
Obr. 2 Grafické
znázornenie závislosti početnosti od vzdialenosti N···F (a) a početnosti od hodnoty uhla N–H···F
(b) vo vodíkových väzbách typu NH···FBF3–.
Následné experimentálne štúdium sústavy Cu(II) - L–L - BF4– viedlo k príprave a
charakterizácii nových zlúčenín [Cu(men)2(BF4)2]
(1), [Cu(bmen)2(BF4)2] (2) a [{Cu(OH)(H2O)(tmen)}2](BF4)2
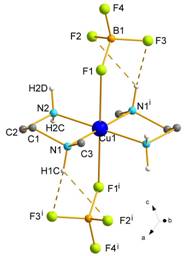
(3). Výsledky monokryštálovej
štruktúrnej analýzy zlúčeniny 1 ukázali,
že jej kryštálová štruktúra je tvorená
molekulami [Cu(men)2(BF4)2],
v ktorých atóm Cu(II) je koordinovaný deformovane oktaedricky v tvare 4+2 dvoma
molekulami chelátového liganda men v
ekvatoriálnej rovine (priemerná hodnota Cu-N je 2,0243(12) Å), kým
axiálne polohy obsadzujú monodentátne BF4– ligandy (Cu-F
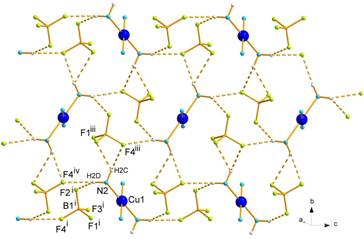
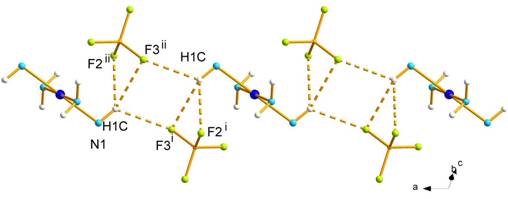
je 2,5091(11) Å) (Obr. 3). Kryštálová štruktúra 1 je stabilizovaná intra- a intermolekulovými vodíkovými
väzbami typu N-H···F [9]. Výsledky sa
diskutujú v prednáške.
a)
b)
c)
Obr. 3 Štruktúra zlúčeniny 2
(a) a jej vodíkové väzby v rovine a
(b) v rovine bc (c).
Literatúra
1. C. Ruiz-Perez, Y.Rodriguez-Martin,
M. H.Molina, F. S.Delgado, J.Pasan, J.Sanchiz, F.Lloret, M.Julve, Polyhedron, 22 (2003), 2111.
2. C. Desplanches, E. Ruiz, A. Rodriguez-Fortea, S.
Alvarez, J. Am. Chem.Soc. 124 (2002) 5197-5205.
3. I. Labadi, L. Parkanyi, R.
Grobelny, J. Mrozinski, Polyhedron, 13 (1994) 2767.
4. I. Potočňák, M. Vavra, E. Čižmár, K.
Tibenská, A. Orendáčová, D. Steinborn, C. Wagner, M. Dušek, K. Fejfarová, H.
Schmidt, T. Műller, M. Orendáč, A. Feher,
J. Sol. State Chem. 179 (2006) 1965
5. J. Kuchár, J. Černák, Z. Mayerová, P. Kubáček, Z. Žák, Solid State
Phenomena 90-91 (2003) 323-328.
6. J. Černák, M. Orendáč, I. Potočňák, J. Chomič, A. Orendáčová, J. Skoršepa,
A. Feher, Coord. Chem. Rev. 224 (2002) 51-66.
7. F. H. Allen, S. Bellard, M. D. Brice, B. A. Cartwright, A. Doubleday, H. Higgs,
T. Hummelink, B. G. Hummelink-Peters, O. Kennard, W. D. S. Motherwell, J. R. Rodgers,
D. G. Watson, Cambridge Structural Database System (CSDS), Cambridge, UK,
(Verzia 5.3 september 2009) (1994).
8. G. R. Desiraju, T. Steiner, The Weak
Hydrogen Bond, New York, Oxford, Oxford University Press, (2001).
9. J. Černák, J. Haníková, J. Kuchár, E. Čižmár, Z. Trávníček, J. Mol. Struct., 963 (2010) 71.
Poďakovanie
Táto práca
vznikla s finančnou podporou grantov APVV-0006-07, VEGA 1/0089/09, VVGS
37/09-