Synthesis of α-Fe and Fe2Zr particles
embedded in ZrO2 matrix
P. Roupcová, O. Schneeweiss
Ústav fyziky materiálů AV ČR v.v.i., Žižkova
22, 616 62 Brno
roupcova@ipm.cz
Keywords: nanocrystalline
materials, zirconium oxide, iron nanocrystals, Mössbauer spectroscopy
Abstract
Iron and Fe2Zr
nanoparticles in zirconium oxide matrix have been prepared by heat treatment of
a mixture of ferrihydrite and zirconium hydride powders. Changes in the phase
composition of the as-mixed powders during annealing in vacuum at 620 °C
and 800 °C
were monitored using measurement of thermomagnetic curves and XRD in heating
chamber. Structure and phase composition of the final products were
characterized by X-ray powder diffraction and 57Fe Mössbauer spectroscopy. The influence
of the composition of the original mixture and temperature on the final properties
of the composites are discussed. The
XRD determined 55 % monoclinic ZrO2, 23 % Fe2Zr, 14 % Zr
and 8 % α-Fe phases in the sample annealed at 800 °C. The mean coherent
length was 20-80 nm. The annealing at 620 °C does not create the Fe2Zr
and the sample consists of 39 % monoclinic ZrO2, 35 % Zr, 22 %
α-Fe and 4 % ZrH2 phases.
Úvod
Oxidy železa nebo fáze na
bázi Fe-Zr v matrici ZrO2 byly zkoumány pro
schopnost stabilizovat ZrO2 v kubické a
tetragonální formě, schopnost ukládat vodík, sloužit jako geterová ochrana
materiálu ve vakuových systémech nebo jako barvivo keramických materiálů.
V soustavě Fe-Zr se
vyskytují podle rovnovážného diagramu [1] tyto fáze: čisté železo (α-Fe), Fe3Zr,
Fe2Zr, t-FeZr2, FeZr3 a α-Zr. Maximální
rozpustnost Zr v α-Fe (bcc) je 0,05 at. % při 925 °C.
Rozpustnost Fe v α‑Zr (hcp) při 730 °C
dosahuje 0,03 at. %. Intermetalické sloučeniny mají za pokojové teploty tyto
strukturní parametry: Fe3Zr (fcc), Fe2Zr je Lavesova
fáze, FeZr2 je tetragonální (I4/mcm) a FeZr3 je
ortorombická (Cmcm). Další fáze (jako např. w fáze) jsou metastabilní. Mössbauerovská spektra těchto
fází byly popsány v práci [2]. Feromagnetické fáze Fe2Zr je popsána
dvěma sextety se záporným isomerním posuvem (δ) a hyperjemným polem Bhf = 19,9
a 18,6 T. Parametry paramagnetických fází jsou: FeZr3 izomerní posuv
δ = ‑0,32
mm/s a kvadrupólové štěpení ΔEQ = –0,36 mm/s a FeZr2
(δ = –0,32
mm/s a ΔEQ = 0,45 mm/s). Spolehlivě lze také tyto fáze
rozlišit chováním ve vnějším magnetickém poli za nízkých teplot 4,2 K.
Fáze bohaté na zirkon (FeZr2, FeZr3 a α-Zr) mají schopnost
ukládat vodík [3]. Proces ukládání vodíku má za následek výrazné změny objemu
základní buňky těchto fází a jejich úplnou nebo částečnou transformaci na fáze
Fe2Zr, α-Fe a ZrH2. O podobných výsledcích s ukládáním vodíku se
zmiňuje i práce [4], která se zabývá hydrogenací materiálů slitých
v obloukové peci v čistém Ar. Jedná se o materiály Zr3FeOx
(x=0,2÷1), kdy je kyslík je přidáván ve formě ZrO2. Vzorek byl
hydrogenován v peci při 300÷400 °C pod tlakem 0,1÷0,12 MPa.
Oproti výchozímu stavu FeZr3 dochází ke změně rozměrů mřížky jak
během oxidace, tak i během hydrogenace. Při hydrogenaci mřížky došlo k její objemové expanzi. Expanze
byla způsobena ukládáním vodíku do intersticiálních mezer. Vyskytovaly se zde
změny magnetického chování. Zatímco materiál Zr3FeOx byl
paramagnetický, hydrogenací se stal antiferomagnetickým. Toto je typické pro
hydrogenaci amorfních materiálů na bázi Fe-Zr [5].
Naopak materiálům bohatým
na oxidy zirkonu a železa se věnují práce [6, 7]. Práškový materiál byl připraven
kalcinací [6]. Během žíhání se ionty Fe3+ (δ = 0,3 mm/s
a ΔEQ = 1 mm/s) rozpouští v matrici
zirkonu a způsobují její částečnou transformaci na tetragonální ZrO2.
U podobného vzorku s větším podílem oxidů železa při teplotě žíhání nad 1000 °C
způsobily oxidy železa obarvení keramiky na korálově červenou barvu [7]. Během
tepelného zpracování se ionty železa vylučovaly z intersticiálních poloh
tetragonálního ZrO2 (t‑ZrO2) a precipitovaly ve
formě α–Fe2O3 na jeho povrchu. To mělo za následek
transformaci a t-ZrO2 na m-ZrO2.
V rovnovážném stavu
je ZrO2 za pokojové teploty monoklinické (m‑ZrO2) [8].
K polymorfní přeměně dochází při 1205 °C, kdy se
struktura změní na tetragonální (t–ZrO2). Další fázová transformace
na kubickou ZrO2 (c‑ZrO2) nastává při 2377 °C.
Kvůli výraznému zlepšení mechanických vlastností, snazšímu zpracování a
stabilitě struktury v důsledku deformace se používají i tetragonální a
kubická ZrO2. K jejich stabilizaci se průmyslově využívá Y2O3.
Schopnost stabilizace byla pozorována i u iontů Fe2+ a Fe3+,
kdy směs FeO (δ = 1,26 a 0,95 a ΔEQ = 2,4 a 2 mm/s) a
α–Fe2O3 stabilizuje tetragonální ZrO2 a
Fe2O3 kubické ZrO2.
Experimentální metody
Materiál byl připraven smísením
prášku ZrH2 s čistotou 99,7 % od firmy Alfa Aesar
v poměru 2:1 s ferihydritem vyrobeným chemickou syntézou. Následně byl
prášek homogenizován ve vakuu (~10-2 Pa) při teplotách 620 °C a 800 °C.
Pro studium fázového
složení tohoto materiálu bylo použito rentgenové práškové difrakce (XRD) a
Mössbauerovy spektroskopie (MS). Rentgenová difrakce práškového materiálu byla provedena
na přístroji X´Pert s užitím záření CoKα. Kvalitativní analýza byla
provedena za pomocí programu HighScore Plus a databáze JCPDS PDF-4. Podíl fází
byl určen z difraktogramu Rietweldovou metodou s využitím
strukturních modelů založených na ICSD databázi. Mössbauerovo spektrum 57Fe
bylo měřeno v transmisním módu na konvenčním spektrometru se zdrojem 57Co/Rh.
Kalibrace byla provedena na α-Fe za pokojové teploty. Pro výpočet
parametrů jednotlivých komponent spekter (intenzitu I, u sextetu hyperjemná
magnetická indukce Bhf [mm/s], isomerní posuv δ [mm/s] a
kvadrupólový posuv εQ
[mm/s], u dubletu isomerní posuv δ a kvadrupólového rozštěpení ΔEQ
[mm/s], a u singletu už jen isomerní posuv δ) byl požit program Confit [9].
Magnetické vlastnosti
byly měřeny na vibračním magnetometru (VSM). Termomagnetická křivka, která
ukazuje teplotní závislost magnetického momentu, byla měřena při teplotách
20÷800 °C ve vakuu (~10-2 Pa).
Výsledky experimentu
Ferihydrit je za pokojové
teploty superparamagnetický. Magnetický přechod byl pozorován v rozmezí teplot
115÷25 K [10]. Pod touto teplotou je uspořádán speromagneticky. Po
smíchání byly provedeny analýzy pomocí rentgenové práškové difrakce a
Mössbauerovy spektroskopie. Zatím co XRD ukazuje pouze přítomnost ZrH2
se střední velikostí koherentních domén (MCL) 46nm, z MS je patrné nemagnetické
spektrum odpovídající ferihydritu (δ = 0,33 mm/s, ΔEQ = 0,65 mm/s)
na Obr. 1.
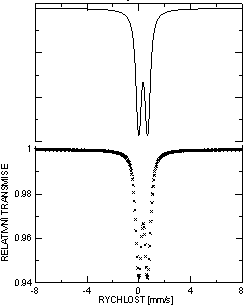
Obr. 1. Mössbauerovské spektrum prášku smýchaného
s ZrH2+ferihydritu před homogenizací.
Tepelné zpracování vzorku
proběhlo během měření termomagnetické křivky pomocí vibračního magnetometru ve
vakuu při dvou rozdílných teplotách (620 °C a 800 °C). Termomagnetická křivka ukazuje ohřev
materiálu do 800 °C
je na obr. 2. Na křivce ohřevu je vidět nárůst magnetického momentu okolo
teploty ~ 230 °C. K nárůstu dochází pravděpodobně
vlivem přeměny ferihydritu na magnetické oxidy železa (nejpravděpodobněji Fe3O4).
Ty se dále postupně redukují na čisté železo, jehož tranzitní teplota je dobře
patrná při teplotě 770 °C. Na křivce chladnutí je
strmý nárůst magnetického momentu poblíž ~ 300 °C,
který by mohl odpovídat Curieově teplotě Fe2Zr. Při zpracování do 620 °C
je vidět na křivce ohřevu stejný průběh nárůstu a poklesu magnetického momentu
až do teploty 620 °C. Curieova teplota na křivce
chladnutí Fe2Zr není tak výrazná jako byla u zpracování při 800 °C.
V místě tranzitní teploty magnetitu není patrný žádný výrazný nárůst ani pokles
magnetického momentu. Proto lze předpokládat, že se magnetit nebude v materiálu
žíhání vyskytovat.

Obr. 2. Teplotní závislost magnetického momentu
vzorku ZrH2+ferihydrit ve vodíku při 800 a 620 °C. Šipky naznačují
tranzitní přechody fází, které by se mohly ve vzorku vyskytovat: α-Fe (770 °C)
[1], magnetitu (577 °C) [10] a Fe2Zr
(280 °C)
[1].
U vzorku tepelně
zpracovaného při teplotě 800
°C ukazuje XRD 55 % m-ZrO2 (MCL 29 nm),
23 % Fe2Zr (MCL 20 nm), 8 % α-Fe (MCL 77 nm) a
14 % α-Zr (MCL 63 nm). U vzorku zpracovaného při teplotě 620 °C
převládá 39 % m-ZrO2 (MCL 22 nm), 35 % α-Zr (MCL 41 nm),
22 % α-Fe (MCL 95 nm) a zbytek 4 % ZrH2. Na obr. 3 je
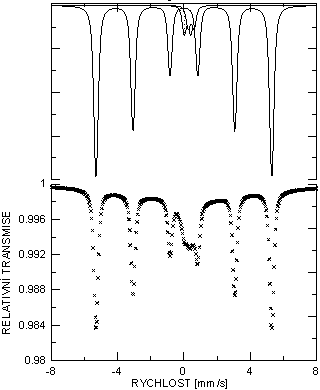
Mössbauerovské spektrum vzorku žíhaného při 800 °C. To je složeno z
komponent odpovídajících relativnímu podílu fází: 0,14 rel.pod. α-Fe
(Bhf = 33 T, δ = 0,02 mm/s,
εQ = -0,02 mm/s), 0,63+0,17 rel.pod. Fe2Zr (Bhf = 19,3 T,
δ = -0,18 mm/s, εQ = 0,06 mm/s;
Bhf = 16,9 T, δ = -0,18 mm/s,
εQ = ‑0,08 mm/s) a 0,06 rel.pod. Fe3+
(δ = 0,27 mm/s, ΔEQ = 0,1 mm/s).
Materiál zpracovaný při 620
°C (obr. 4) se skládá z: 0,75 rel.pod. α-Fe, 0,15
rel.pod. Fe3+ (δ = 0,22 mm/s, ΔEQ = 0,19 mm/s)
a 0,10 rel.pod. Fe2+/3+ (δ = 0,43 mm/s,
ΔEQ = 0,17 mm/s). Porovnáním těchto analýz s
termomagnetickou křivkou lze říct, že během ohřevu do teploty ~ 600 °C vzniká nejprve
α-Zr a α-Fe, Fe2Zr se začíná pravděpodobně utvářet až za
vyšších teplot. Ionty Fe3+ a Fe2+/3+ se ani v jednom
případě nepodílí na stabilizaci ZrO2, nedochází tudíž k vzniku
tetragonálního ani kubického ZrO2. Přítomnost těchto iontů lze u
materiálu žíhaných při teplotách 800
°C i 620
°C vysvětlit jako zbytkový podíl ferihydritu. Z fázové
analýzy provedené pomocí MS bylo potvrzeno, že se ve vzorku po tepelném
zpracování nevyskytoval žádný magnetit.
Závěr
Smícháním ZrH2 a ferihydritu a následným tepelným zpracováním za vysokých teplot
(620 °C
a 800 °C)
ve vakuu jsme získali prášek tvořený jemnými částicemi. Výsledné fázové složení
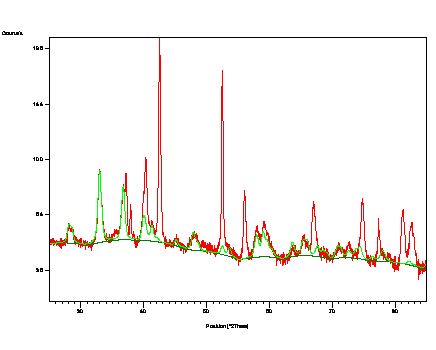
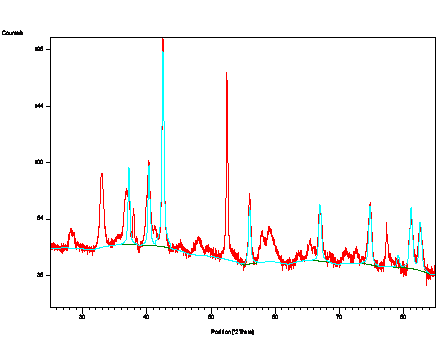
se lišilo podle teploty zpracování. U vzorku, který byl homogenizován při 620 °C na obr. 5 byly pomocí
fázových analýz XRD i MS objeveny zbytky fází použitých k přípravě
materiálu před jeho tepelným zpracováním. XRD detekovala 4 % ZrH2 a MS 0,15 rel.pod. Fe3+ a 0,10 rel.pod. Fe2+/3+ odpovídající ferihydritu. Mimo to se zde
vyskytovalo monoklinické ZrO2, α-Zr a α-Fe. Oproti tomu při teplotě 800 °C vznikl materiál
tvořený většinovým podílem 55% m-ZrO2, 23 % Fe2Zr, 8 % α-Fe a
14 % α-Zr. Pouze 0,06 rel.pod. Fe3+
je podle detekce MS, tvořeno fází, kterou nemůžeme jednoznačně identifikovat.
|

|
|
|
Obr. 3. Mössbauerovské spektum prášku ZrH2+ferihydrit
po TMC při teplotě 800 °C
ve vakuu: α-Fe (sextet plná čára), Fe2Zr (dva
sextety s výplní) a Fe3+ (dublet).
|
Obr. 4. Mössbauerovské spektum prášku ZrH2+ferihydrit
po TMC při teplotě 620 °C
ve vakuu: α-Fe (sextet), a Fe3+ a Fe3+/2+
(dva dublety).
|
References
1. H. Okamoto, J. Phase Equilibria 14
(1993), No. 5., 652.
2. F. Aubertin, U. Gonser, S. J. Cambell, H.
G. Wagner, Z. Metallkde, 76 (1985) (4) 237.
3. V.A. Yartys, H. Fjellvåg, I.R.
Harris, B.C. Hauback, A.B. Riabov, M.H. Sørby, I.Yu. Zavaliy, J. Alloys Comp. 293–295 (1999) 74.
4. I. Yu. Zavaliy, R.V. Denys, R. Černý, I.V. Koval’chuck,
G. Wiesinger, G.Hilscher, J Alloys Comp,
386 (2005) 26-34.
5. E. Kuzmann, M. L. Lakatos-Varsanui, K. Nomura, Y. Ujihira,
T. Masumoto,G.
Principi,
C. Tosello,
K. Havancsak,
A. Vertes, Electroch Commun 2 (2000) 130.
6. E. Carreto, C. Pina, H. Arriola, C. Barahona,
N. Nava, V. Castano, J Radioanal Nucl Ch, 250
(2001) (3) 453.
7. P. Tartaj, T. González-Carreño, C. J.
Serena, M. Ocana J Solid State Chem, 128 (1997) 102.
8. V. V. Kriventsov, D. I. Kochubey,
Y. V. Maximov, I.
P. Suzdalev,
M. V. Tsodikov,
J. A. Navio,
M. C. Hidalgo,
G. Colon., Nucl Instrum Meth A, 470 (2001),
341.
9. T.
Žák, in Mössbauer Spectroscopy in Materials Science, edited by M.
Miglierini & D. Petridis, (Dordrecht:
Kluwer Academic Publishers) 1999, p 385.
10. R.
M. Cornell, U. Schwertmann, The Iron Oxides. Strucure, Properties,
Reactions, Occurence and Use. Weinheim: VCH, 1996, pp. 120-123.
|
a) m-ZrO2
|
b) α-Zr
|
|
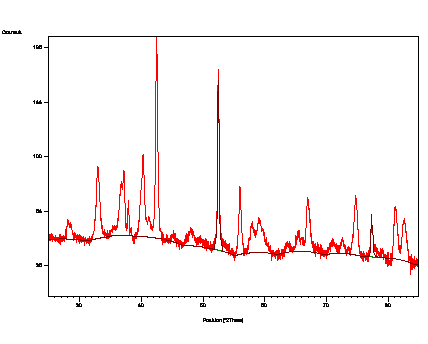
c) α-Fe
|
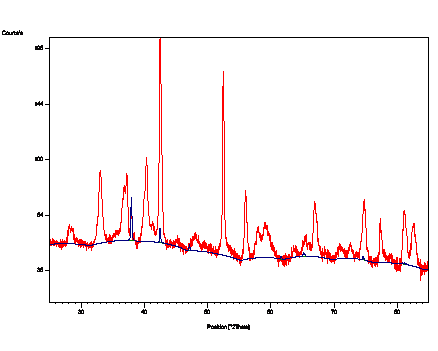
d) ZrH2
|
Obr. 5. Difraktogram prášku ZrH2+ferihydrit
po homogenizaci při 620 °C
s upřesněnými parametry nalezených fází.
Poděkování.
Autoři této práce
děkují Dr. T. Grygarovi (Ústav anorganické chemie AV v. v. i. v Řeži) za
syntézu ferihydritu. Tato práce vznikla za finanční podpory projektu
1M6198959201 Ministerstva školství, mládeže a tělovýchovy České republiky.







