Metody experimentálního určení fází (MIR, MAD, SAD) v krystalografické
analýze biologických
makromolekul
Jiří Brynda
Ústav molekulární genetiky Akademie věd ČR, Flemingovo nám. 2, 166 37, Praha 6
„Vstup molekulární biologie a biochemie do tzv. “post-genomické éry” a následující výraznější zaměření pozornosti světové komunity molekulárních biologů na studium struktur a funkcí jednotlivých genových produktů (enzymů), pak v posledních letech zavedlo rentgenovou strukturní analýzu (respektive tzv. krystalografii proteinovou) jako jednu ze základních experimentálních metodik i těchto oborů.“ tolik citace J. Marek a Z. Trávníček, kolokvium 2002. Úvodní citací chci jen doložit, že problematika RTG strukturní analýzy se stále více posouvá do pozornosti zájmu biologických disciplín, a že jsou velmi často řešeny nové struktury biomakromolekuůl bez znalosti funkce či strukturní homologie. Proto je problém experimentálního určení fází stále důležitější.
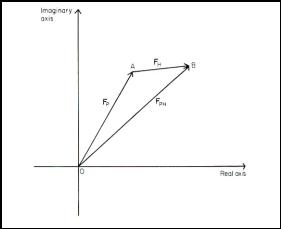
Dnes již klasickou metodou je vícenásobná izomorfní modifikace (MIR – multiple isomorphous replacement). Metoda je založena na specifickém navázání atomů s velkým počtem elektronů na povrch molekuly proteinu v krystalu. Analýzou rozdílů intenzit reflexí nativního krystalu (nemodifikovaného krystalu viz. obr.1) a krystalů modifikovaných různými atomy v různých pozicích, viz. obr.2, lze odhadnout správné fáze jednotlivých reflexí. Nejdůležitější podmínkou pro požití této metody je příprava opravdu izomorfně modifikovaných krystalů tak, aby opravdu platil vektorový součet strukturních faktorů FPH = FP + FH, kde FPH je strukturní faktor modifikovaného krystalu, FP - strukturní faktor nativního krystalu a FH -strukturní faktor těžkého atomu, viz. obr. 3.
Obr. 1. Nativní krystal.
Obr. 2. Krystal modifikovaný Obr. 3. Geometrická interpretace vekt.
jedním těžkým atomem. součtu FPH = FP + FH.
Pokud tedy máme výše zmíněná data, můžeme pomocí Pattersonovy funkce určit polohy těžkých atomů v modifikovaných strukturách a poté můžeme zrekonstruovat vektorové součty, viz obr. 4 a 5. Takto lze získat počáteční fáze pro výpočet mapy elektronových hustot. Pokus se podaří připravit pouze jeden derivát s těžkým atomem viz. obr. 4 (SIR – Single Isomorphous Replacement), lze za příznivých okolností řešit problém nejednoznačného určení fáze výpočetně programem OASIS http://www.ccp4.ac.uk/dist/html/oasis.html. V případě, že se podaří připravit více kvalitních derivátů mělo by být určení fází jednoznačné viz. obr. 5 (MIR – Multiple Isomorphous Replacenet).
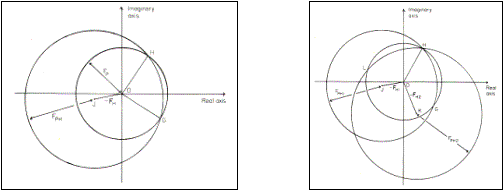
Obr. 4. Geometrická
interpretace Obr.
5. Geometrická interpretace
určení fází metodou SIR. určení fází metodou MIR.
Další velmi účinné metody experimentálního fázování využívají jevu
anomální disperse. K anomální dispersi dochází pokud energie dopadajících
fotonů RTG záření je vyšší než energie některého přechodu elektronu na
vnitřních hladinách, tj. v blízkosti absobční hrany (viz. např. http://www.doe-mbi.ucla.edu/~sawaya/m230b/anomalous5.ppt).
Tento jev se projeví dvěma efekty: za prvé dojde k absorbci záření (sníží
se velikost atomového rozptylového faktoru o korekční faktor f’) a za druhé dojde reemisi fotonu
s fázovým zpožděním o p/2 (korekční
faktor f‘‘, obr. 6) navíc jsou
hodnoty obou příspěvků závislé na vlnové délce záření.
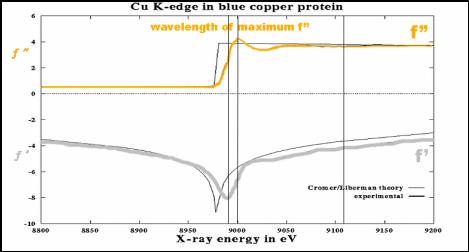
Obr. 6. Závislost faktorů f’ a f’’ na energii záření pro protein obsahující měď, svislé čáry naznačují energie záření vhodné pro měření MAD (Multiple Anomalous Dispersion).
Pokud je použit atom, jehož absorbční hrana je experimentálně nedostupná, ale anomální příspěvek dostatečný, lze diferenci mezi Friedelovými páry Fhkl a F-h-k-l pro necentrosymetrické reflexe využít stejně jako v případě metody vícenásobného izomorfního nahrazení, pak se jedná o metodu SAD (Single Anomalous Dispersion), viz. obr. 7. Metodu MAD je výhodné použít pokud náš krystal obsahuje prvek, jehož absorbční hrana je experimentálně dostupná (synchrotronová pracoviště), např. Se-methioninem modifikovaný protein. Velikou výhodou je zde absolutní izomorfie a měření většinou při všech třech vlnových délkách lze provést se stejným krystalem, a v obrázku 7 by bylo možno přidat ještě čtyři další kružnice.
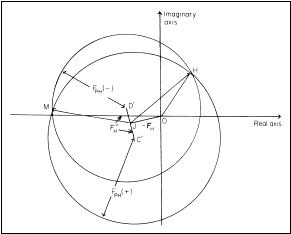
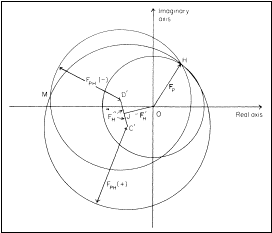
Obr. 7. Geometrická interpretace určení fází Obr. 8. Geometrická interpretace určení
metodou SAD. fází kombinací metod SIR a SAD.
Všechny výše uvedené metody a jejich kombinace jsou úspěšně používány k řešení problému fází a programové vybavení potřebné pro tyto metody lze najít například na následujících internetových adresách:
SOLVE/RESOLVE http://www.solve.lanl.gov/
SHARP/autoSHARP http://babinet.globalphasing.com/
a velmi pěkně zpracované stránky metody MAD na adrese:
http://babinet.globalphasing.com/people/gwyndaf/Thesis-html/Thesis.html
Literatura:
Protein Crystallography ![]()
Author: Tom Blundell & Louise Johnson, Academic Press.
![]()
Practical Protein Crystallography - Second edition. ![]()
Author: Duncan E. McRee. ![]()
Publisher: Academic Press 1999. ![]()
ISBN: 0-12-486052-4.
Podrobná osnova příspěvku:
1. Úvod
2. Teorie metod MIR a SIR
3. Teorie metod SAD, MAD a MIR+AD
4. Nalezení poloh těžkých nebo AD atomů
5. Určení fází
6. Programy
7. Závěr