Pro studium krystalových struktur je vhodné znát prostorové grupy a také tzv. ekvivalentní polohy.
Umístíme-li výchozí bod do obecné polohy, bude
operacemi prostorové grupy opakován tolikrát, kolik operací tato grupa
vlastní. Umístíme-li však výchozí bod do některé speciální polohy, tj.
například na nějaký prvek symetrie, bude počet symetricky sdružených (ekvivalentních) poloh menší, neboť některé polohy se ztotožní. Počet
ekvivalentních poloh dané skupiny symetricky sdružených poloh se nazývá
obor. V krystalových strukturách je počet atomů v buňce určen právě tímto
oborem skupiny ekvivalentních poloh. V tabulce jsou uvedeny ekvivalentní
polohy prostorové grupy P4im2. Při označování skupiny
ekvivalentních poloh se udává:
1. Obor skupiny, tj. počet vzájemně ekvivalentních poloh.
2. Wyckoffův symbol skupiny ekvivalentních poloh. Toto označení začíná písmenem
a u nejspeciálnější polohy (s nejmenším oborem) a postupuje přes písmena
abecedy až k obecné poloze.
3. Bodová symetrie výchozí polohy (a tudíž i ekvivalentních poloh).
4. Souřadnice ekvivalentních poloh vzhledem ke krystalografickým osám.
| Obor | Wyckoffovo označení | Symetrie umístění | Souřadnice bodů ekvivalentních poloh |
| 8 | l | 1 | x y z, -x -y z, -x y z, x
-y z , -y x -z, y -x -z, y x -z, -y -x -z |
| 4 | k | m | x 1/2 z, -x 1/2 z, 1/2 x -z, 1/2 -x -z |
| 4 | j | m | x 0 z, -x 0 z, 0 x -z, 0 -x -z |
| 4 | i | 2 | x x 1/2, -x -x 1/2, x -x 1/2, -x x 1/2 |
| 4 | h | 2 | x x 0, -x -x 0, x -x 0, -x x 0 |
| 2 | g | 2mm | 0 1/2 z, 1/2 0 -z |
| 2 | f | 2mm | 1/2 1/2 z, 1/2 1/2 -z |
| 2 | e | 2mm | 0 0 z, 0 0 -z |
| 1 | d | 4im2 | 0 0 1/2 |
| 1 | c | 4im2 | 1/2 1/2 1/2 |
| 1 | b | 4im2 | 1/2 1/2 0 |
| 1 | a | 4im2 | 0 0 0 |
To znamená, že například, pokud je atom v poloze d, není operacemi
symetrie zmnožen. Naopak atom v poloze h je zmnožen 4x. To je třeba vzít
do úvahy při řešení například víceatomové struktury. Polohy atomů musí
být ve shodě s chemickým složením (poměr počtu různých atomů v chemickém
vzorci).Wyckoffův symbol slouží především
k rozlišení poloh se stejným oborem a stejnou symetrií. Polohy označené zlomky jsou pevně fixovány symetrií
krystalu, zatímco souřadnice x, y, z se mohou od krystalu
ke krystalu lišit a je úkolem strukturní analýzy tyto souřadnice určit.
Jelikož určují polohy atomů, nazývají se atomové parametry.
Zápis xx0 znamená x = x, y = x, z = 0. 
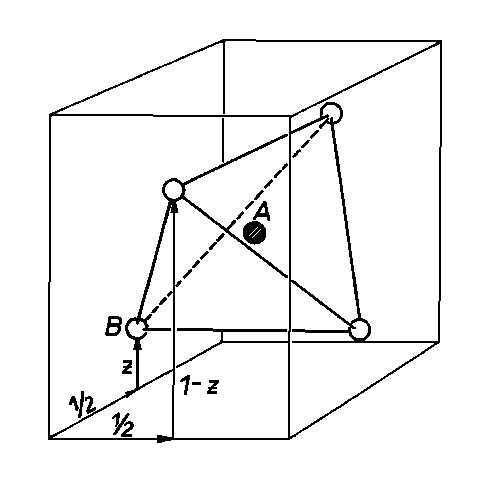
Jako příklad využití ekvivalentních poloh vyšetřujeme koordinační mnohostěn vytvořený nejbližšími atomy k atomu A umístěnému v poloze 1c, tj. v poloze 1/2 1/2 1/2 prostorové grupy P41m2. Nechť se nejbližší atomy B nacházejí např. v polohách 2g. Tato skupina ekvivaletních poloh sice obsahuje pouze dvě polohy, 0, 1/2, z a 1/2, 0, -z, k nim jsou však translačně ekvivalentní další dvě polohy 1, 1/2, z a 1/2, 1, -z. Spojením středů atomů na obrázku vznikne čtyřstěn, tetraedr. Atom A se tudíž nachází v tzv. tetraedické koordinaci.
V této kapitole jsou uvedeny vybrané typy krystalových
struktur, které se nejčastěji vyskytují ve fyzice pevných látek. Uvedené
příklady mají spíše ilustrativní charakter, neboť v odborné literatuře
bývá zvykem se na známé strukturní typy odvolávat bez dalšího popisování
jejich struktury.
Měď, Cu
Struktura mědi je příkladem struktury s nejrozšířenějším kubickým plošně centrovaným uspořádáním atomů vázaných kovovými vazbami. Tato skutečnost je na obrázku zvýrazněna pomocí dvou základních buněk. Šrafovaně jsou vyznačeny roviny s nejtěsnějším směstnáním atomů, které jsou kladeny na sebe ve směrech <111> v posloupnosti ABCABCABC... . Základní buňka obsahuje čtyři atomy v polohách 0 0 0 ; 1/2 1/2 0 ; 1/2 0 1/2 ; 0 1/2 1/2 . Prostorová grupa symetrie je Fm3im.
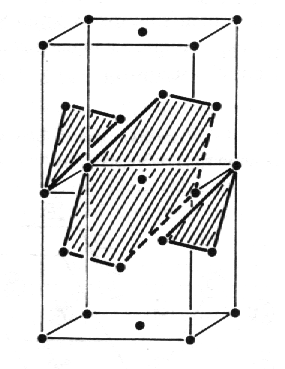 | |
| Struktura mědi, Cu. | |
Cesium, Cs
má symetrii danou prostorovou grupou Im3im. Každý mřížový bod prostorově centrované mříže je obsazen jedním atomem, takže na základní buňku připadají dva atomy v polohách 0 0 0 a 1/2 1/2 1/2. Tato struktura není nejtěsněji směstnaná.
| Struktura césia, Cs. |
Hořčík, Mg
Prostorová grupa symetrie této struktury je P63/mmc, tudíž mříž je hexagonální a primitivní. Na základní buňku připadají dva atomy. Zvolíme-li počátek mříže ve středu symetrie, pak jsou souřadnice poloh těchto dvou atomů 1/3 2/3 1/4 a 2/3 1/3 3/4. Na obrázku je znázorněna projekce této struktury podél osy c. Ve fyzice kovů bývá zvykem volit počátek mříže tak, že leží ve středu jednoho z atomů. Na obrázku vpravo je tato mříž vyznačena tečkovaně a polohy atomů vzhledem k této mříži jsou pak vyjádřeny souřadnicemi 0 0 0 a 1/3 2/3 1/2. Atomy tedy leží v polohách 0 a 1/2 nad základnou buněk. Při této volbě počátku není struktura středově symetrická vzhledem k tomuto počátku. Názornější přehled o rozložení atomů získáme znázorněním poloh atomů v šestibokém hranolu, který je složeninou tří základních buněk (na obrázku je základna tohoto hranolu vyznačena čárkovaně).
Uspořádání atomů odpovídá přibližně hexagonálnímu nejtěsnějšímu uspořádání stejných koulí vrstvených nad sebou ve směru [001] v posloupnosti ABABABAB.... Poměr mřížových parametrů c/a je roven 1,6235 a je mírně nižší než ideální hodnota 1,633 odpovídající stejným koulím ve vzájemném dotyku. Ještě větší odchylka od této ideální hodnoty se vyskytuje u dalších typických kovů, zinku a kadmia, kde je poměr c/a přibližně roven 1,86. Tyto odchylky od ideálního vzoru těsně směstnaných koulí indikují podíl kovalentní vazby v těchto převážně kovově vázaných atomových strukturách.
Křemík, Si
Tato struktura je charakteristická i pro germanium, diamant a šedý cín (který je stálý při nízkých teplotách). Symetrie této struktury je Fd3im, na každý mřížový bod plošně centrované mříže připadají dva atomy v polohách 0 0 0 a 1/4 1/4 1/4. Na základní buňku tedy připadá celkem 4 . 2 = 8 atomů. Všechny atomy se nacházejí v tetraedrické koordinaci. Křemík je nejvíce využívaným polovodičovým materiálem v současné mikroelektronice.
Grafit, C
Uhlík kromě diamantu krystalizuje rovněž ve formě grafitu. Rovinné hexagonální sítě vznikají kovalentní vazbou hybridních orbitalů sp2. Zbývající elektrony (jeden elektron na atom) nejsou lokalizované a vysvětlují vysokou elektrickou vodivost grafitu ve směru podél hexagonálních rovin.
| Struktura křemíku, Si. | Struktura uhlíku, C. Zeleně je vyznačena základní buňka. |
Arsen, As
vytváří podobně jako antimon a bismut vrstevnatou strukturu. Ve vrstvách má každý atom tři nejbližší sousedy a skládáním vrstev vznikne struktura s romboedrickou mříží (trigonální soustava).
| Struktura arsenu, As. Modrým rámem a fialovou barvou atomů je vyznačena základní buňka. |
Tellur, Te
a selen vytvářejí struktury složené ze spirálově vinutých řetězců. Směrový charakter vazebných orbitalů se projevuje úhlem 105° mezi vazbami.
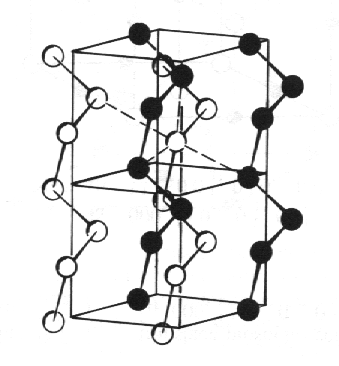 |
| Tellur, Te. |