VIII.(b) ZÁKLADNÍ TYPY KRYSTALOVÝCH STRUKTUR
3. Struktury binárních slitin
Nejjednodušší slitiny vznikají mezi dvěma kovy se stejnou valencí a podobnou velikostí atomů. Pokud tyto kovy mají v čistém stavu stejnou krystalovou strukturu, mohou se jejich atomy zpravidla nahrazovat (substituovat) v celém oboru koncentrací a vznikají tzv. substituční tuhé roztoky (např. Au-Ag, Ti-Zr, K-Rb). Substituční tuhé roztoky mohou vznikat i mezi nekovovými prvky, např. Si-Ge a Se-Te. Závislost mřížových parametrů na koncentraci složek je podle Vegardova pravidla lineární nebo jenom mírně odlišná od lineárního chování (tyto odchylky často indikují uspořádání na krátkou vzdálenost). Se vzrůstajícím rozdílem atomových velikostí složek nebo při jejich rozdílné struktuře je vznik úplného tuhého roztoku nemožný; koncentrační obor rozpustnosti je pak omezen (např. Ag-Cd).
Při náhodném nahrazování jedněch atomů druhými vznikají neuspořádané tuhé roztoky. Jejich strukturu můžeme charakterizovat základní buňkou vzniklou průměrováním přes všechny buňky krystalu. Každá atomová poloha je pak obsazena daným druhem atomu s pravděpodobností danou (při náhodném obsazování poloh) podílem počtu těchto atomů k celkovému počtu atomů ve struktuře. Obecně je pravděpodobnost obsazování atomových poloh popsána obsazovacím číslem, které může nabývat hodnoty od nuly do jedné. Pro určité poměry počtu atomů lze pomalým ochlazováním z vysokých teplot dosáhnout uspořádání atomů a vznik uspořádaného tuhého roztoku. Jako příklad jsou na obr. 8.18 uvedeny uspořádané struktury CuAu, Cu3Au a Fe3Al.
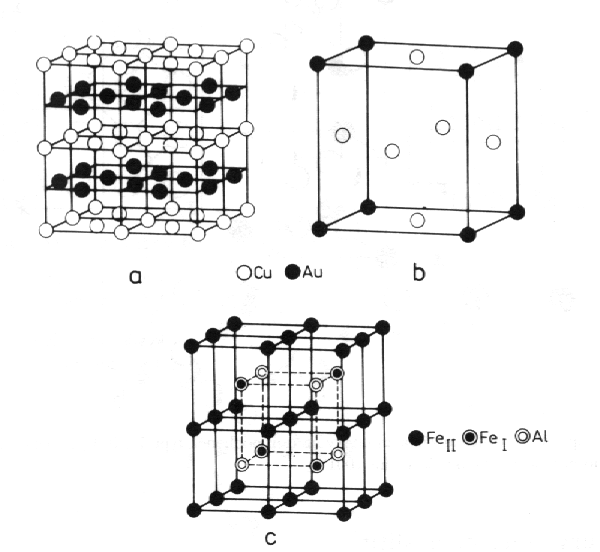 |
| Obr. 8.18 Uspořádané tuhé roztoky: a) tetragonální CuAu, b) kubický Cu3Au, c) kubický Fe3Al. |
Intersticiální sloučeniny, vytvářené přechodnými prvky v kombinaci s vodíkem, borem, uhlíkem a dusíkem, si lze představit pomocí dvou podstruktur. První je tvořena kovovými atomy A, které vytvářejí jakousi kostru s vysokým stupněm směstnání atomů A. Druhá podstruktura je vytvářena atomy B (H, B, C, N), které zaujímají polohy v mezerách první kovové podstruktury. Některé příklady těchto tzv. intersticiálních poloh jsou uvedeny v tabulce 8.1 a na obr. 8.19. V posledním sloupci tabulky 8.1 jsou uvedeny poměry poloměrů koulí obsazujících polohy B a A tak, aby menší koule B právě vyplnily mezery mezi nejtěsněji směstnanými většími koulemi A.
| Podstruktura kovových atomů | Intersticiální polohy | Počet poloh v buňce | Koordinace | rB/rA |
| kubické plošně centrované směstnání | 1/4 1/4 1/4, 0 0 1/2 |
8 4 | tetraedrická oktaedrická | 0,225 0,414 |
| kubické prostorově centrované směstnání | 1/2 0 ±1/4, 0 1/2 ±1/4, 1/2 ±1/4 0, 0 ±1/4 1/2, ±1/4 0 1/2, ±1/4 1/2 0, |
12 | tetraedrická | 0,291 |
| hexagonální, nejtěsnější směstnání | 0 0 ±3/8, 2/3 1/3 ±1/8, 1/3 2/3 ±1/4 |
4 2 | tetraedrická oktaedrická | 0,225 0,414 |
| hexagonální, primitivní mříž | 2/3 1/3 1/2 | 1 | prizmatická | 0,530 |
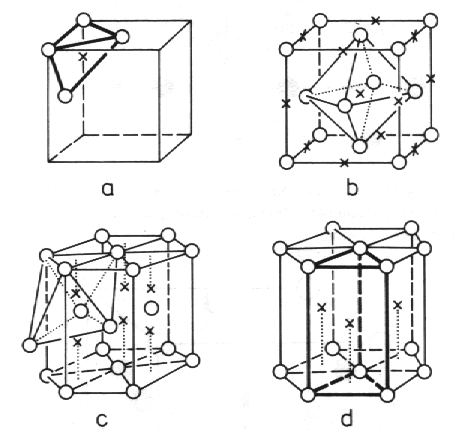 |
| Obr. 8.19 Intersticiální polohy: a) a b) tetraedrické a oktaedrické polohy v kubickém plošně centrovaném uspořádání, c) oktaedrické polohy v hexagonálním nejtěsnějším uspořádání, d) prizmatické polohy ve struktuře s atomy kovu v mřížových bodech primitivní hexagonální mříže. Atomy kovu jsou vyznačeny kroužky, intersticiální polohy křížky. |
Mezi význačné zástupce intersticiálních sloučenin patří karbidy a nitridy přechodných kovů Ti, Zr, Hf, V, Nb a Ta, které vynikají vysokou tvrdostí, žáruvzdorností a chemickou odolností. Tyto karbidy a nitridy vytvářejí struktury typu NaCl. Ve skutečnosti však nikdy nejsou všechny intersticiální polohy obsazeny, a proto je přesnější psát vzorec těchto sloučenin ve tvaru MeCx nebo MeNx, kde Me symbolizuje daný přechodný kov a index x < 1 souvisí s atomovou koncentrací c uhlíku nebo dusíku vztahem x = c / (100 - c). I když si karbidy a nitridy zpravidla zachovávají elektrickou vodivost základního kovu, jejich vysoká tvrdost a vysoké teploty tání svědčí o významném podílu kovalentních vazeb v těchto strukturách (např. teplota tání čistého titanu je 1677°C, zatímco u karbidu TiC dosahuje 3067°C).
Struktury typu NiAs (obr. 8.20) a Nb3Ge (obr. 8.21). Ve struktuře NiAs vytvářejí atomy arsenu hexagonální nejtěsnější směstnání a v této podstruktuře se nacházejí atomy niklu v oktaedrických polohách. Látky s touto strukturou mají často proměnné složení, které můžeme vyjádřit vzorcem MexB, s proměnným indexem x v intervalu od 0,8 do 2,0. Pro x > 1 jsou obsazovány další polohy, ±(1/3 2/3 3/4), atomy kovu (Me). Struktura supravodivé slitiny Nb3Ge (Tc = 23,2 K) patří ke strukturnímu typu W3O. Tuto kubickou strukturu mají i další supravodivé slitiny V3Si, Nb3Sn a další.
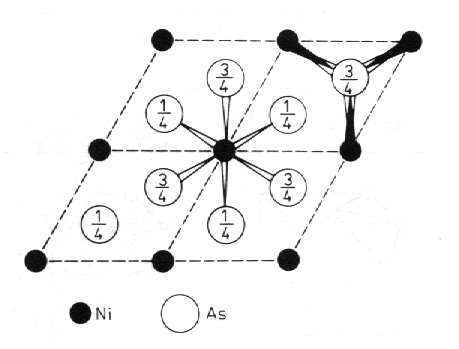 |
| Obr. 8.20 Projekce čtyř základních buněk NiAs do roviny (001); atomy niklu se nacházejí ve výškách 0 a 1/2 (jsou v projekci překryté) a mají oktaedrickou koordinaci; atomy arsenu jsou obklopeny šesti atomy niklu ve vrcholech trojbokého hranolu. |
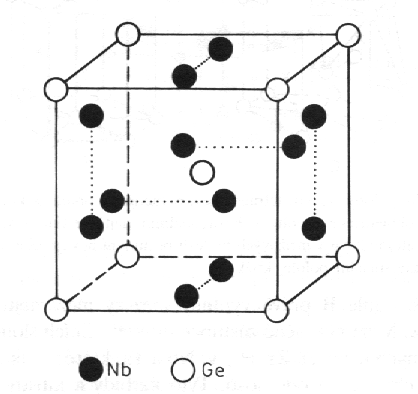 |
| Obr. 8.21 Struktura Nb3Ge. |
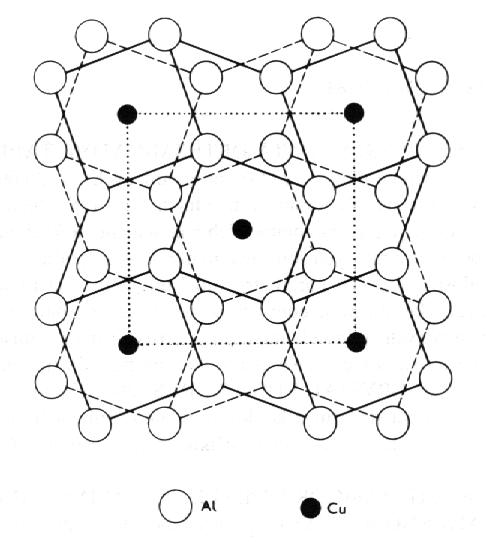
Struktury typu CuAl2 (obr. 8.22) a TiCu3 (obr. 8.23) jsou příkladem slitin typu AB2 a AB3, ve kterých je uspořádání atomů určeno především jejich velikostí. Ve struktuře CuAl2 se menší atomy mědi nacházejí v polohách s desetičetnou koordinací, zatímco atomy hliníku mají osmičetnou koordinaci. Na obr. 8.23 jsou znázorněny dva případy nejtěsnějšího směstnání atomů v rovině pro složení AB3. Vrstvením rovin na obr. 8.23a vznikne struktura typu TiCu3, vrstvy znázorněné na obr. 8.23b se vyskytují ve struktuře AuCu3 (uvedené též na obr. 8.18b). Všechny varianty vrstvení vytvářejí mnohostěny atomů B kolem atomů A s koordinačním číslem 12.
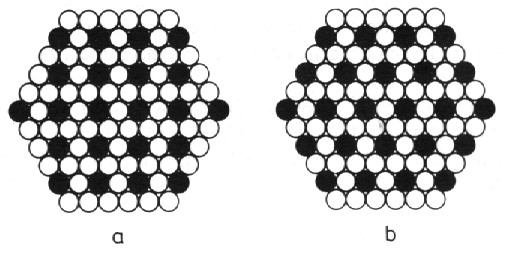 |
| Obr. 8.23 Těsně směstnané vrstvy o složení AB3. Vrstvením rovin (a) vzniknou např. struktury TiCu3, vrstvením rovin (b) struktury Cu3Au. |