VIII.(a) ZÁKLADNÍ TYPY KRYSTALOVÝCH STRUKTUR
V této kapitole jsou uvedeny vybrané typy krystalových struktur,
které se nejčastěji vyskytují ve fyzice pevných látek. Uvedené příklady mají spíše ilustrativní
charakter, neboť v odborné literatuře bývá zvykem se na známé strukturní typy odvolávat bez
dalšího popisování jejich struktury.
1. Krystalové struktury prvků
Měď, Cu (obr. 8.1, animace 8.1). Struktura mědi je příkladem struktury s kubickým plošně centrovaným směstnáním atomů * vázaných kovovými vazbami. Tato skutečnost je na obr. 8.1. zvýrazněna pomocí dvou základních buněk. Šrafovaně jsou vyznačeny roviny s nejtěsnějším směstnáním atomů, které jsou kladeny na sebe ve směrech <111> v posloupnosti ABCABCABC... . Základní buňka obsahuje čtyři atomy v polohách 0 0 0 ; 1/2 1/2 0 ; 1/2 0 1/2 ; 0 1/2 1/2 . Prostorová grupa symetrie je Fm3im.
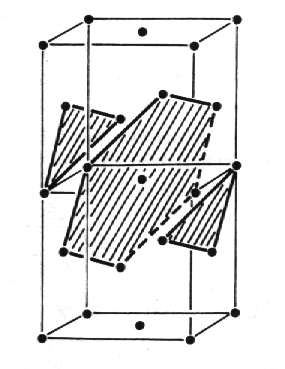 |
| Obr. 8.1 Struktura mědi s kubickým plošně centrovaným směstnáním atomů (pro názornost jsou zakresleny dvě základní buňky nad sebou). |
|
|
| Animace 8.1: Struktura mědi, Cu. |
Cesium, Cs (animace 8.2) má symetrii danou prostorovou grupou Im3im. Každý mřížový bod prostorově centrované mříže je obsazen jedním atomem, takže na základní buňku připadají dva atomy v polohách 0 0 0 a 1/2 1/2 1/2. Tato struktura není nejtěsněji směstnaná.
|
|
| Animace 8.2: Struktura césia, Cs. |
Hořčík, Mg (obr. 8.3 a animace 8.3). Prostorová grupa symetrie této struktury je P63/mmc, tudíž mříž je hexagonální a primitivní. Na základní buňku připadají dva atomy. Zvolíme-li počátek mříže ve středu symetrie (tj. v poloze se symetrií 3im1), jak je pravidlem v mezinárodních krystalografických tabulkách, pak jsou souřadnice poloh těchto dvou atomů 1/3 2/3 1/4 a 2/3 1/3 3/4. Na obr. 8.3 je znázorněna projekce této struktury podél osy c. Plnou čarou jsou spojeny mřížové body mříže umístěné počátkem v 3im1 a výška atomů nad základnou buněk je dána zlomky uvnitř kroužků znázorňujících atomy. Ve fyzice kovů bývá zvykem volit počátek mříže tak, že leží ve středu jednoho z atomů. Na obr. 8.3 vpravo je tato mříž vyznačena tečkovaně a polohy atomů vzhledem k této mříži jsou pak vyjádřeny souřadnicemi 0 0 0 a 1/3 2/3 1/2. Atomy tedy leží v polohách 0 a 1/2 nad základnou buněk. Při této volbě počátku není struktura středově symetrická vzhledem k tomuto počátku. Názornější přehled o rozložení atomů získáme znázorněním poloh atomů v šestibokém hranolu, který je složeninou tří základních buněk (na obr. 8.3 vpravo je základna tohoto hranolu vyznačena čárkovaně).
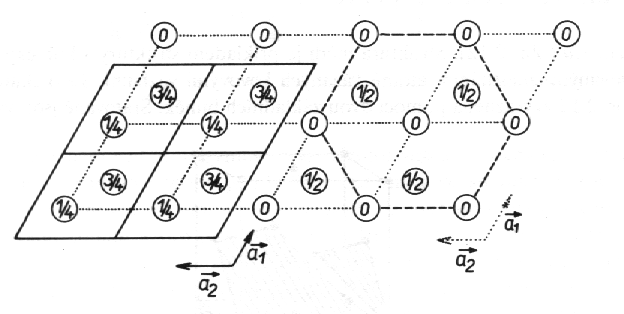 |
| Obr. 8.3 Projekce struktury hořčíku, Mg, podél osy c. Čísla uvnitř kroužků označují výšky atomů nad základnou buňky pro dvě různé volby počátku (viz text). |
Uspořádání atomů odpovídá přibližně hexagonálnímu nejtěsnějšímu směstnání* stejných koulí vrstvených nad sebou ve směru [00.1] v posloupnosti ABABABAB... ( animace 8.3). Poměr mřížových parametrů c/a je roven 1,6235 a je mírně nižší než ideální hodnota 1,633 odpovídající stejným koulím ve vzájemném dotyku. Ještě větší odchylka od této ideální hodnoty se vyskytuje u dalších typických kovů, zinku a kadmia, kde je poměr c/a přibližně roven 1,86. Tyto odchylky od ideálního vzoru těsně směstnaných koulí indikují podíl kovalentní vazby v těchto převážně kovově vázaných atomových strukturách.
|
|
| Animace 8.3: Struktura hořčíku, Mg. Modře je vyznačena základní buňka (2 atomy na buňku), červeně a zeleně střídání vrstev ABABABA... . |
Křemík, Si (animace 8.4). Tato struktura je charakteristická i pro germanium, diamant a šedý cín (který je stálý při nízkých teplotách). Symetrie této struktury je Fd3im, na každý mřížový bod plošně centrované mříže připadají dva atomy v polohách 0 0 0 a 1/4 1/4 1/4. Na základní buňku tedy připadá celkem 4 . 2 = 8 atomů. Všechny atomy se nacházejí v tetraedrické koordinaci. Křemík je nejvíce využívaným polovodičovým materiálem v současné mikroelektronice.
|
|
| Animace 8.4: Struktura křemíku, Si. |
Grafit, C (animace 8.5). Uhlík kromě diamantu krystalizuje rovněž ve formě grafitu. Rovinné hexagonální sítě vznikají kovalentní vazbou hybridních orbitalů sp2. Zbývající elektrony (jeden elektron na atom) nejsou lokalizované a vysvětlují vysokou elektrickou vodivost grafitu ve směru podél hexagonálních rovin.
|
|
| Animace 8.5: Struktura uhlíku, C. Zeleně je vyznačena základní buňka. |
Arsen, As (animace 8.6), vytváří podobně jako antimon a bismut vrstevnatou strukturu. Ve vrstvách má každý atom tři nejbližší sousedy a skládáním vrstev vznikne struktura s romboedrickou mříží (trigonální soustava).
|
|
| Animace 8.6: Struktura arsenu, As. Modrým rámem a fialovou barvou atomů je vyznačena základní buňka. |
Tellur, Te (obr. 8.8) a selen vytvářejí struktury složené ze spirálově vinutých řetězců. Směrový charakter vazebných orbitalů se projevuje úhlem 105° mezi vazbami.
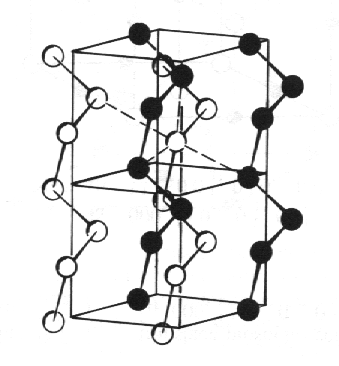 |
| Obr. 8.8 Tellur, Te. |
2. Polární struktury
Jak již bylo uvedeno výše, je pro struktury tvořené více než jedním druhem atomů obecně charakteristická asymetrie interakce mezi atomy. Jako příklad uveďme následující binární sloučeniny tvořené atomy prvků třetí periody Mendělejevovy tabulky, u kterých připadají v průměru na jeden atom čtyři valenční elektrony, jako u křemíku ( počty valenčních elektronů jsou uvedeny v závorkách):
| Si(4) | struktura typu diamantu, |
| Al(3)...P(5) | struktura typu sfaleritu, |
| Mg(2).....S(6) | struktura typu NaCl, |
| Na(1).......Cl(7) | struktura typu NaCl. |
Sloučenina AlP krystalizuje ve struktuře typu sfaleritu (obr. 8.11), ve které jsou polohy atomů stejné jako u diamantové struktury křemíku, ale čtyři nejbližší sousedé každého atomu jsou opačného druhu Rozdíl v nábojích jader obou druhů atomů a rozdíl elektronových afinit vedou k asymetrickému rozdělení hustoty valenčních elektronů, s posunem těžiště hustoty ve směru k atomům fosforu. Tento jev je ještě výraznější u dalších dvou sloučenin, MgS a NaCl. U NaCl je asymetrie v rozdělení náboje již taková, že je možné rozlišit ionty Na+ a Cl-. Obě tyto sloučeniny mají stejnou strukturu typu NaCl (obr. 8.9), ve které je každý iont obklopen šesti ionty opačné polarity.
Chlorid sodný, NaCl (animace 8.8). Symetrie struktury je Fm3im. Na plošně centrovanou kubickou buňku připadají čtyři vzorcové jednotky NaCl, tj. na každý mřížový bod dva opačné ionty. Pro polohy iontů najdeme v seznamu ekvivalentních poloh dané prostorové grupy následující souřadnice:
| Cl- | 4a | 0 0 0 | + | translace plošného centrování |
| Na+ | 4b | 1/2 1/2 1/2 | (tj. 0 0 0 , 1/2 1/2 0 , | |
| 1/2 0 1/2 , 0 1/2 1/2 ) | ||||
Po úpravě dostaneme
| Cl- | 4a | 0 0 0 , 1/2 1/2 0 , 1/2 0 1/2 , 0 1/2 1/2 |
| Na+ | 4b | 1/2 1/2 1/2 , 0 0 1/2 , 0 1/2 0 , 1/2 0 0 |
(Připomeňme, že poloze o souřadnici 1/2 + 1/2 = 1 odpovídá translačně ekvivalentní souřadnice v počátku). U krystalu NaCl nemůžeme hovořit o molekulách, neboť nelze rozhodnout, která dvojice iontů Na+ a Cl- odpovídá molekule, na rozdíl od molekul NaCl v plynném stavu.
|
|
| Animace 8.8: Chlorid sodný, NaCl. Ionty Cl- značeny modře, ionty Na+ zeleně. |
Chlorid cesný, CsCl (obr. 8.10) je dalším typickým iontovým krystalem. Má strukturu se symetrií Pm3im, tudíž primitivní mříž. Na základní buňku připadá jedna vzorcová jednotka CsCl. Jelikož uprostřed buňky leží atom odlišný od atomů umístěných ve vrcholech buňky, nelze tuto strukturu popsat kubickou prostorově centrovanou mříží. Odporovalo by to základní vlastnosti mříže, která spočívá v tom, že každý mřížový bod má stejné okolí. Poměr poloměrů iontů je 0,922 a v souladu s tabulkou 7.1 je koordinační číslo této struktury rovno osmi, tj. každý iont je obklopen osmi ionty opačného náboje.
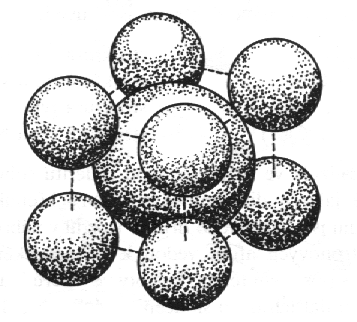 |
| Obr. 8.10 Chlorid cesný, CsCl. |
Vliv polarizace iontů. Rozdílná velikost iontů se neuplatňuje pouze jako geometrický faktor, pochopitelný z modelu směstnaných koulí nestejného poloměru, ale má ještě další nepřímý vliv na strukturu iontových sloučenin. Poměrně vysoká intenzita pole na "povrchu" malého kationtu vede k tendenci částečně zvrátit proces přerozdělení náboje při vytváření iontové struktury, a tak vytvořit směrový charakter vazeb vlivem polarizace. Malý kationt je účinný polarizátor a způsobuje vysokou polarizaci velkých aniontů. Tato polarizace byla skutečně ověřena experimentálně měřením odrazivosti v optické oblasti. Důsledkem směrového charakteru vazeb vlivem polarizace iontů je výskyt struktur jiného typu, než by odpovídal poměru poloměrů iontů podle tabulky 7.1. Například soli CuF, CuCl, CuBr a AgI, které by z hlediska velikosti iontů měly vytvářet stabilní struktury typu NaCl, krystalizují ve strukturách typu sfaleritu nebo wurtzitu (viz níže).
Sfalerit, ZnS (obr. 8.11). Tato struktura je typickou strukturou binárních polovodičů, jako je např. GaAs, InP, CdTe a řada dalších. Polohy atomů, popsané v rámci prostorové grupy F4i3m, jsou následující:
| Zn | 4a | 4i3m | 0 0 0 , 0 1/2 1/2 , 1/2 0 1/2 , 1/2 1/2 0 |
| S | 4c | 4i3m | 1/4 1/4 1/4 , 1/4 3/4 3/4 , 3/4 1/4 3/4 , |
| 3/4 3/4 1/4 | |||
Každý atom má čtyři stejně vzdálené sousedy - atomy opačného druhu - umístěné ve vrcholech tetraedru. Všimněme si také, že atomy síry vytvářejí uvnitř buňky další tetraedr, přičemž atomy zinku obsazují mřížové body plošně centrované kubické buňky. Kdyby všechny atomy byly stejné, je toto uspořádání totožné se strukturou diamantu (obr. 8.5).
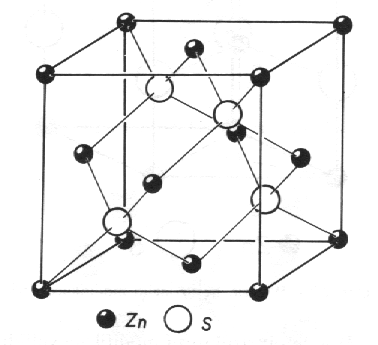 |
| Obr. 8.11 Sfalerit, kubická modifikace sulfidu zinečnatého, ZnS. |
Wurtzit, ZnS (obr. 8.12) je jinou strukturní modifikací sulfidu zinečnatého, s prostorovou grupou symetrie P63mc. Základní buňka primitivní hexagonální mříže obsahuje dvě vzorcové jednotky ZnS. Polohy atomů jsou
| Zn | 2b | 3m | 1/3 2/3 u, | (2/3 1/3 1/2) + u | u = 0 |
| S | 2b | 3m | 1/3 2/3 u, | (2/3 1/3 1/2) + u | u = 0,375 |
Nad každým atomem zinku se nachází atom síry v poloze o 0,375 délky hrany c výše. Každý atom má opět tetraedrickou koordinaci opačných atomů, stejně jako u sfaleritu. Strukturu typu wurtzitu mají významé polovodiče, jako např. CdS, CdSe, ZnO.
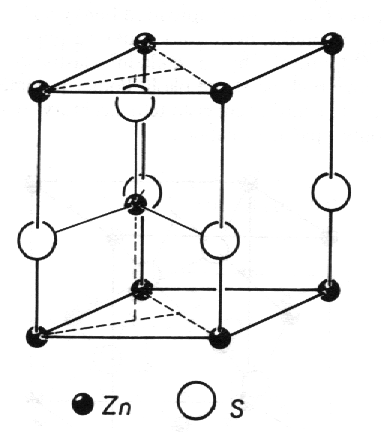 |
| Obr. 8.12 Wurtzit, hexagonální modifikace ZnS. |
Fluorit, CaF2 (obr. 8.13), rutil, TiO2 (obr. 8.14) a cristobalit, SiO2 (obr. 8.15), jsou příklady sloučenin, ve kterých má nestejný poměr počtu atomů složek za následek nestejnou koordinaci obou druhů atomů. Větší záporné ionty zpravidla určují těsnost směstnání.
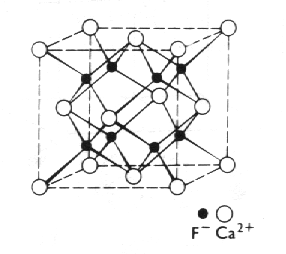 |
| Obr. 8.13 Fluorit, kubická buňka CaF2. |
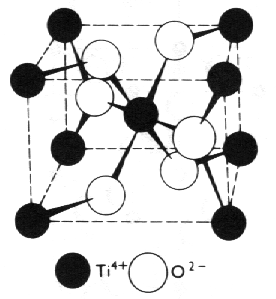 |
| Obr. 8.14 Rutil, tetragonální modifikace TiO2. |
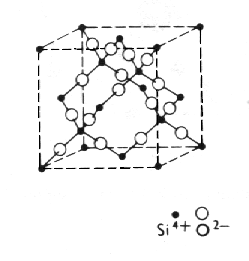 |
| Obr. 8.15 Cristobalit, kubická modifikace SiO2. |
Perovskit, CaTiO3 (obr. 8.16). Krychlová buňka obsahuje jednu vzorcovou jednotku. Ionty Ca2+ se nacházejí ve středu oktaedrů tvořenými ionty O2-. Tuto strukturu má například též titaničitan barnatý, BaTiO3. Při teplotách pod Curieovou teplotou je tato struktura poněkud deformována posunutím iontů Ba2+ a Ti4+ vůči iontům O2-, přičemž vzniká dipólový moment, symetrie struktury se snižuje z kubické na tetragonální a krystal je feroelektrický.
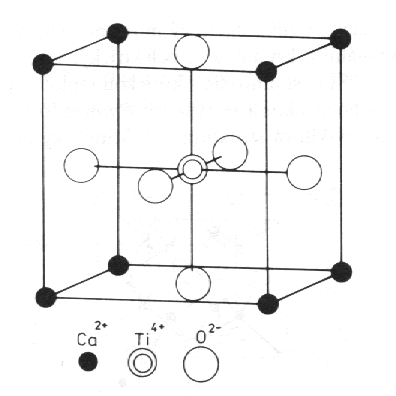 |
| Obr. 8.16 Perovskit, CaTiO3. |
Spinel, MgAl2O4 (obr. 8.17). Krychlová základna obsahuje 32 atomů kyslíku uspořádaných nejtěsnějším kubickým směstnáním. Kovové ionty vyplňují tetraedrické mezery (A) nebo oktaedrické mezery (B). U normálního spinelu obsazují dvojmocné ionty polohy A a trojmocné ionty polohy B. Vzorec takovéhoto spinelu pak můžeme přesněji psát jako A2+B23+O4. U inverzních spinelů, jako např. u MgFeO4, jsou polohy A obsazeny ionty Fe3+ a polohy B jsou statisticky náhodně obsazovány ionty Mg2+ a Fe3+. Strukturně správný vzorec tohoto inverzního spinelu je pak Fe3+(Mg3+Fe3+)O4. Strukturu inverzního spinelu má též například magnetit, Fe3O4.
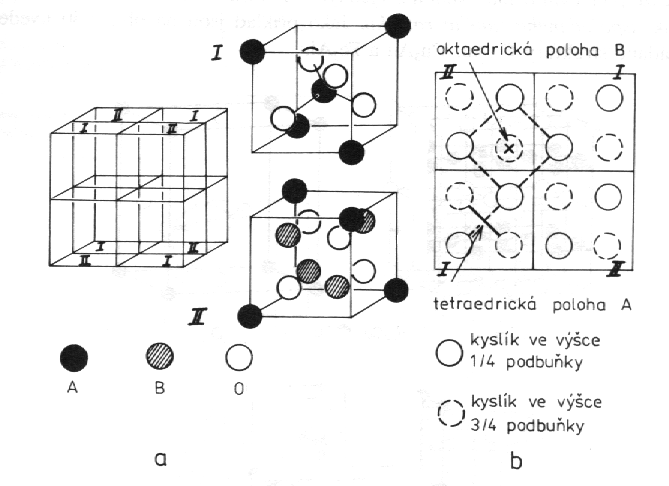 |
| Obr. 8.17 Spinel: a) rozdělení základní buňky na osm podbuněk typu I a II, b) projekce kyslíkových atomů v horní polovině buňky do roviny (001). |