Kryokrystalografie biologických makromolekul
Pavlína Řezáčová
Ústav molekulární genetiky Akademie věd ČR, Flemingovo n. 2, 166 37 Praha 6
Úvod
Krystaly biologických makromolekul jsou při laboratorní teplotě vysoce citlivé k rentgenovým paprskům a často podléhají radiačnímu poškození, zejména při použití synchrotronového záření s vysokou intenzitou [1]. Většinou je toto poškození tak rychlé, že k nasnímání nezbytného množství difrakčních dat je potřeba několika různých krystalů a někdy dokonce není možné měření provést. Již v roce 1970 bylo pozorováno, že difrakční měření krystalů biomolekul za nízkých teplot (kolem 100K) značně snižuje či dokonce eliminuje radiační poškození a tím zvyšuje kvalitu získaných dat [
2]. Na krystaly biologických makromolekul tak byla aplikována technika v té době již více než dvacet let používaná v krystalografii malých molekul [3 ]. Musely však být překonány další těžkosti s chlazením krystalů biologických makromolekul vyplývající z vysokého obsahu rozpouštědla a tvorby krystalů vody při chlazení na velmi nízké teploty [4 ]. Teprve v devadesátých letech minulého století se metody měření biokrystalů za nízkých teplot začaly široce používat a kryokrystalografie se stala mocným nástrojem krystalografie biologických makromolekul. Následující odstavce budou věnovány představení kryokrystalografie a výhod použití velmi nízkých teplot pro skladování, transport i difrakční měření krystalů, jakož i některým experimentálním aspektům. Detaily a další informace lze nalézt v řadě souhrnných článků [5,
6, 7, 8, 9].
Radiační poškození
| Poškození krystalů biologických makromolekul účinkem rentgenového záření je způsobeno vznikem volných radikálů (zejména H* a OH* vzniklých rozpadem molekul vody) a jejich šířením v krystalu. Radiační poškození je provázeno změnami mřížkových parametrů, které mění pozici difrakčních maxim a změnami profilů difrakcí a typicky se projeví na snížené kvalitě nasnímaných difrakčních dat [10 ].
Fotochemický proces, při němž vznikají v krystalu po dopadu rentgenového záření volné radikály, je označován jako primární radiační poškození. Vysoce reaktivní částice se v krystalu šíří a na relativně vzdálených místech mohou následně probíhat chemické reakce projevující se jako sekundární radiační poškození. Typickým příkladem sekundárního radiačního poškození u proteinů je štěpení disulfidických můstků, dekarboxylace kyselých aminokyselinových zbytků a v extrémním případě i porušení peptidové vazby.
Šíření volných radikálů v krystalech makromolekul difúzí je podporováno vysokým obsahem rozpouštědla (až 80%). Snížením teploty na teplotu tekutého dusíku (kolem 100K), lze difúzi značně zpomalit a tím omezit propagaci vysoce reaktivních částic v krystalu a následné sekundární radiační poškození (obrázek 1).
Snížením teploty nelze eliminovat primární radiační poškození, ale to představuje problém pouze pro extrémně slabě difraktující krystaly [11 ]. |
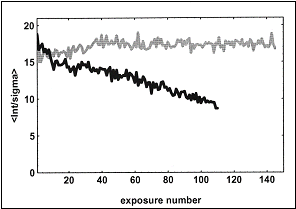 |
| Obrázek 1: Poměr <I/s(I)> (kde I je intenzita difrakce a
s(I) standardní odchylka) pro následné 1° oscilační snímky krystalu lysozymu. Data byla nasnímána při teplotě
300 K (šedě) a 120 K (černě) na beamline BW7B a X11, DESY, Hamburk. Převzato z [
12]. |
Difrakční experiment při nízké teplotě
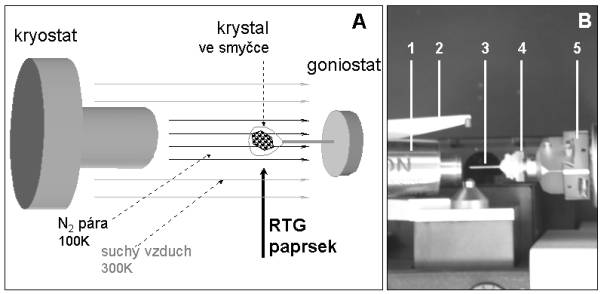
Schéma typického uspořádání difrakčního experimentu za kryogenních podmínek je zobrazeno na obrázku 2A. Namísto ve skleněné kapiláře, je krystal uchycen ve smyčce z tenkého vlákna (většinou nylonového o průměru 10 - 20 mm) a zchlazen specifickou technikou tak, aby se zabránilo tvorbě ledových krystalů a poškození krystalu. Smyčka je opatřena magnetickou bází, pomocí níž může být lehce umístěna na goniometrickou hlavičku difraktometru. Nízká teplota je udržována po celou dobu difrakčního experimentu proudem chladných par dusíku z chladícího zařízení, kryostatu. Chladné dusíkové páry jsou většinou získávány elektrickým ohřevem tekutého dusíku v Dewarově nádobě. Chladný proud je zamířen přímo na krystal a kolem zaštítěn proti okolní vlhkosti koncentrickým proudem teplého vysušeného vzduchu. Na obrázku 2B je fotografie skutečného uspořádání experimentu pro měření krystalů biologických makromolekul při nízké teplotě.
|
|
| Obrázek 2: A. Schéma uspořádání difrakčního experimentu za kryogenních podmínek.
B. Fotografie uspořádání difrakčního experimentu za kryogenních podmínek. 1 – kryostat (Oxford Cryosystems, UK), 2 – beamstop, 3 – smyčka pro uchycení krystalu (Hampton Research, USA), 4
- magnetická báze, 5 – goniometrická hlavička (Hampton Research, USA). |
Příprava krystalu na chlazení
| Jak již bylo zmíněno, pro krystaly biologických makromolekul je charakteristický vysoký obsah rozpouštědla. Rozpouštědlo se nachází nejen uvnitř krystalu, v kanálech mezi jednotlivými molekulami, ale i na povrchu a tvoří 30 – 80 % celkového objemu krystalu. Hlavní těžkostí při chlazení krystalů na nízkou teplotu je zabránit tvorbě hexagonálních krystalů ledu. Zvětšení specifického objemu o 9 % při fázovém přechodu vody na led může způsobit mechanické poškození krystalové mříže krystalu makromolekuly a ledové krystaly navíc ovlivňují difrakční měření (tzv. vodní kruhy, viz obrázek 3).
K chlazení biokrystalů je tedy nezbytně nutné použít takový postup, který vede k vytvoření sklu podobné, amorfní fáze rozpouštědla (tzv. „vitrifikace“ [13]). Toho lze dosáhnout kombinací velice rychlého zchlazení a přidání látky, která zpomaluje nukleaci ledových krystalů, tzv. kryoprotektanty. Tyto látky jsou typicky přidávány v množství 60
- 50 % ke krystalizačnímu roztoku a krystal je v této směsi namočen před zmražením. Většinou je krystal postupně přenášen do směsí se vzrůstající koncentrací kryoprotektantu aby se zamezilo osmotickému šoku, při němž může dojít k prasknutí či rozpuštění krystalu. Doba ponechání krystalu v kryoprotektivní směsi závisí na řadě faktorů (např. velikost krystalu, obsah rozpouštědla, viskozita směsi) a pohybuje se od 2 s do několika hodin až dní. Vhodný kryoprotektant, jeho koncentrace i délka namáčení krystalu je nutno určit experimentálně. Pokud metoda namáčení krystalu v kryoprotektivní směsi selže, např. je-li krystal velice citlivý, lze použít dialýzu kryoprotektantu ke krystalu [14] či krystalizovat přímo v kryoprotektivní směsi [15]. V tabulce 1 jsou shrnuty látky úspěšně používané jako kryoprotektanty v kryokrystalografii biologických makromolekul [7]. Nejčastěji používaným kryoprotektantem je glycerol [16].
|
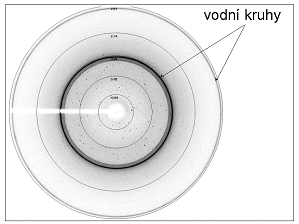
Obrázek
3:
Difrakční snímek krystalu lysozymu zchlazeného na teplotu 100 K
bez přítomnosti kryoprotektantu. Vodní kruhy představují difrakci na
krystalech ledu.
|
|
Tabulka 1.
Úspěšně
používané kryoprotektanty
|
|
Erythriol
|
2-Metyl-2,
4-pentandiol (MPD)
|
|
Etanol
|
Parafínový
olej
|
|
Ethylen
glykol
|
Polyethylen
glykol 400
|
|
Glukosa
|
Polyethylen
glykol 1000 – 10 000
|
|
Glycerol
|
Propylene
glykol
|
|
Metanol
|
Sacharosa
|
Zchlazení krystalu
V závislosti na mechanických vlastnostech lze k zachycení a upevnění krystalu použít skleněná vlákna či skleněné špachtle [17], ale nejčastěji se používají již výše zmíněné smyčky z nylonového vlákna. Pomocí smyčky o vhodné velikosti je krystal vyloven z krystalizačního roztoku či kryoprotektivní směsi a ve smyčce je zachycen povrchovým napětím tenké vrstvy tekutiny. Další praktické detaily této metody uchycování krystalů biologických makromolekul lze nalézt v literatuře [18].
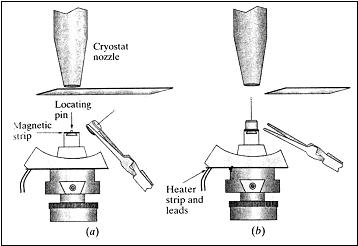
Doba od vylovení krystalu do jeho zchlazení by měla být co nejkratší (ideálně 1s). Aby se zajistilo velice rychlé zchlazení krystalu na nízkou teplotu, musí se krystal dostat do přímého kontaktu s chladícím médiem. Jednoduchým a účinným způsobem je umístění krystalu na goniostat a jeho zchlazení proudem chladných par dusíku přímo na difraktometru. Při umísťování krystalu na goniostat je vhodné proud chladné páry zablokovat a poté naráz uvolnit, aby se dosáhlo rychlého a stejnoměrného zchlazení krystalu (viz obrázek 4). Výhodou tohoto způsobu chlazení je, že krystal je zároveň připraven do výchozí pozice pro následnou analýzu a sběr dat.
 |
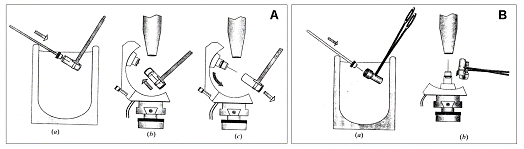
Další metodou zchlazení je rychlé ponoření krystalu ve smyčce do tekutého dusíku či propanu. Zchlazení krystalu touto metodou je rychlejší (chladícímu médiu jsou totiž přístupné obě strany smyčky), což je zvláště důležité pro krystaly větší než 0.4mm. Pro difrakční měření, musí být krystaly zchlazené v tekutém médiu přemístěny na goniostat do proudu chladných par dusíku bez větší změny teploty. Dvě z běžně používaných metod jsou ukázány na obrázku 5. První metoda [18] využívá plastikových zkumavek (běžně používaných pro skladování za nízkých teplot) a u difraktometrů s horizontální osou otáčení ještě přídavné zařízení (angl. arc) [19], které se připojí na goniometrickou hlavičku (obrázek 5A). Smyčka s uchyceným krystalem je po ponoření do tekutého dusíku vložena do plastikové zkumavky. Tekutý dusík v plastikové zkumavce udržuje krystal chladný při jeho transportu na goniostat. Smyčku je nutno umístit na magnetickou bázi ve vertikální poloze, a to umožňuje posuvná magnetická báze umístěná na nástavci goniometrické hlavičky. Chlazení tekutým dusíkem je po odstranění zkumavky nahrazeno proudem z kryostatu a pro difrakční měření se smyčka posune do horizontální polohy. Druhá metoda (obrázek 5B) využívá k přenosu z tekutého chladícího média na goniostat speciální kovové klíšťky [20] s dutinou pro smyčku. Klíšťky jsou nejprve zchlazeny v tekutém dusíku a do nich je umístěna smyčka s krystalem. Při přenosu na goniostat pak zchlazený kov udržuje po určitou omezenou dobu nízkou teplotu. Obě tyto techniky přenosu krystalu z tekutého chladícího média na goniostat mohou být obráceny a využity tak k přemístění krystalu do tekutého média za účelem skladování či transportu. |
Obrázek 4: Schéma chlazení krystalu chladnými parami dusíku. (a) Výstup kryostatu je zablokován a smyčka s krystalem je umístěna na goniometr. (b) Rychlým uvolněním proudu par dusíku se dosáhne náhlého a rovnoměrného zchlazení krystalu. Převzato z [7].
|
| V některých případech lze úspěšně použít metodu opakovaného zchlazení krystalů pro zvýšení difrakčního limitu a snížení mozaicity krystalu. Zchlazený krystal se nechá ohřát na laboratorní teplotu a pak se znovu zchladí, někdy i několikrát následně za sebou. Toho se dosáhne buď přímo na goniostatu, kdy se na několik sekund zablokuje výstup chladné páry z kryostatu [21] či přemístěním krystalu zpět do směsi kryoprotektantu, kde je ponechán minimálně 3 min a pak opět zchlazen [22,
23]. |
 |
|
Obrázek 5: Schéma dvou technik používaných při přenosu krystalu z tekutého chladícího média na goniostat. Komentář v textu. Převzato z [7]. |
Skladování a transport krystalů za nízkých teplot
Při skladování krystalů biologických makromolekul v krystalizačním roztoku může docházet k určitým změnám a zhoršování kvality (stárnutí krystalu, praskání, růst satelitních krystalů). Tomuto lze předejít, pokud se krystaly vhodné k difrakční analýze včas vyberou a zchladí. Pokud úspěšně zchlazeny, mohou být za kryogenních podmínek uchovávány v podstatě nekonečně dlouhou dobu. Krystaly lze například použít k předběžné charakterizaci na laboratorním zdroji a následně uschovat pro měření na synchrotronu. Krystaly je též možné po nasnímání difrakčních dat uschovat a v případě potřeby v budoucnu použít pro další měření.
Neposlední výhodou skladování krystalů v tekutém dusíku je také jejich pohodlný transport. Speciálně konstruované Dewarovy nádoby mohou být použity dokonce i pro bezpečný letecký transport.
Závěr
Využití metod kryokrystalografie přineslo mnoho velkých výhod makromolekulární krystalografii. Výhody, které přináší možnost skladování zchlazených krystalů a jejich transportu byly již zmíněny. Uchycení krystalu do smyčky z tenkého vlákna je v porovnání s umístěním do kapiláry metodou jednodušší a šetrnější ke krystalu, snižuje se jím možnost mechanického poškození krystalu a je možné pracovat s menšími krystaly. Navíc je krystal po zchlazení ve smyčce fixován a nemůže se v průběhu měření pohybovat.
Díky snížení či eliminaci radiačního poškození krystalu za nízkých teplot, je možné používat k difrakčním experimentům intenzivního synchrotronového záření. Z krystalů lze za nízkých teplot získat difrakční data s vyšším rozlišením a intenzitami než za laboratorní teploty nejen díky eliminaci radiačního poškození, ale také proto, že se snižují tepelné vibrace i konformační neuspořádanosti. Potřebná difrakční data lze nasnímat z jediného krystalu, což je zvláště důležité v případě MAD experimentů (angl. multiwavelength anomalous dispersion) [24] či dat získaných na atomárním rozlišení.
Difrakčních měření za různých teplot lze využít ke studiu proteinové dynamiky [25] a nízké teploty může být též využito ke stabilizaci a studiu různých oxidačně-redukčních stavů [26] či enzymových intermediátů [27,
28].
Poznámka: Na závěr si dovolím malou jazykovou tečku týkající se používání termínů „zchlazení“ či „zmražení“. I když se běžně obou termínů užívá jako synonym, mražení dokonce naznačuje nižší teplotu, z fyzikálního hlediska se jako mražení označuje fázový přechod, který má za výsledek vytvoření nové krystalické fáze. Jelikož se při kryokrystalografických experimentech ze všech sil snažíme zabránit vzniku krystalů ledu, jistě pochopíte, proč v celém textu byla dána přednost termínu „zchlazení“.
Literatura:
- W. A. Hendrickson (2000): Synchrotron crystallography. Trends in Biochemical Sciences 25: 637.
- D. J. Haas, M. G. Rosmann (1970): Crystallographic studies on Lactate dehydrogenase at -75°C. Acta Cryst. B26: 998.
- R. Rudman (1976): Low-temperature X-ray diffraction. Plenum Press, New York.
- H. Hope (1988): Cryocrystallography of biological macromolecules: a generally applicable method. Acta Cryst. B44: 22.
- H. Hope (1990): Crystallography of biological macromolecules at ultra-low temperature. Annu. Rev. Biophys. Chem. 19: 107.
- K. D. Watenpaugh (1991): Macromolecular crystallography at cryogenic temperatures. Curr. Opin. Str. Biol. 1: 1012.
- D. W. Rodgers (1994): Cryocrystallography. Structure 2: 1135.
- D. V. Rodgers, Cryocrystallography techniques and devices. In International Tables for Crystallography, Volume F. Crystallography of Biological Macromolecules, Rossmann,M.G. and Arnold, E., ed. (Dordrecht: Kluwer Academic Publishers): 202.
- H. Hope (2001). Introduction to cryocrystallography In International Tables for Crystallography, Volume F. Crystallography of Biological Macromolecules, Rossmann,M.G. and Arnold, E., ed. (Dordrecht: Kluwer Academic Publishers): 197.
- P. Sliz, S.C. Harrison, G. Rosenbaum (1993): How does Radiation Damage in Protein Crystals Depend on X-Ray Dose. Structure 11: 13.
- S.J. Watowich, J.J. Skehel, D.C. Wiley (1988). Cryocrystallography of influenza virus hemagglutinin crystals. Acta Cryst.B44: 22.
- Schneider T. R. (1996): Cryocrystallography of Biological Macromolecules. Proc. of the ISSSRNS´96.
- T. Y. Teng (1990): Mounting crystals for macromolecular crystallography in free-standing thin film. J. Appl. Cryst. 23: 387.
- C. Nagata, H. Moriyama, N. Tanaka, M. Nakasako, M. Yamamoto, T. Ueki, T. Oshima (1996): Cryocrystallography of 3-Isopropylmalate Dehydrogenase from Thermus thermophilus and its Chimeric Enzyme. Acta Cryst.D52: 623.
- E. Garman (1999). Cool data: quantity and quality. Acta Cryst.D55: 1641.
- E. F. Garman, E. P. Mitchell (1996): Glycerol concentrations required for cryoprotection of 50 typical protein crystallization solutions. J. Appl. Cryst. 29 : 584.
- T.-Y. Teng (1998). Cooling rates during flash cooling. J. Appl. Cryst. 31: 252.
- D. Rodgers (1997) Methods Enzymol. 276: 183.
- C. Engel, R. Wierenga, P.A. Tucker (1996) A removable arc for mounting and recovering flash-cooled crystals. J. Appl. Cryst. 29: 208.
- S. Parkin, H. Hope (19 98) Macromolecular crystallography: cooling, mounting, storage and transportation of crystals. J. Appl. Cryst. 31: 294.
- J.I. Yeh, W.G.J. Hol (1998) Acta Cryst.D54: 479.
- J.M. Harp, D.E. Timm, G.J. Bunick (1998): Macromolecular Crystal Annealing: Overcoming Increased Mosaicity Associated with Cryocrystallography. Acta Cryst.D54: 622.
- J.M. Harp, B. Leif Hanson, D.E. Timm, G.J. Bunick (1999): Macromolecular crystal annealing: evaluation of techniques and variables. Acta Cryst.D55: 1329.
- J.L. Smith (1991) Curr. Opin. Struct. Biol. 1: 1002.
- R.F. Tilton, J.C. Dewan, G.A. Petsko (1992): Effects of temperature on protein structure and dynamics: X-ray crystallographic studies of the protein Ribonuclease-A at nine different temperatures from 98 to 320K. Biochemistry 31: 2469.
- W. Watt, A. Tulinsky, R.P. Swenson, K.D.Watenpaugh (1991): Comparison od the crystal structures of a flavodoxin in ith three oxidation states at cryogenic temperatures. J.Mol.Biol. 218: 195.
- B.F. Rasmussen, A.M. Stock, D. Ringe, G.A. Petsko (1992): Crystalline ribonuclease A loses function below the dynamical transition at 220K. Nature 357: 423.
- K. Moffat, R. Henderson (1995): Freeze trapping of reaction intermediates. Curr. Opin. Struct. Biol. 5:656-663.




