Ivana Kutá Smatanová
Ústav fyzikální biologie JčU v ČB a Ústav ekologie krajiny AV ČR, Zámek 136, 373 33 Nové
Hrady
Krystalizace biologických makromolekul představuje jeden z nejefektivnějších nástrojů v strukturní biologii či fyzikální biochemii.
Poznání struktury makromolekulárních látek je nutným předpokladem pro objasnění strukturně-funkčních vztahů a tímto poskytuje podklady pro modifikace makromolekul pro potřeby farmaceutického, medicínského, zemědělského a jiných odvětví průmyslu.
EXPERIENCE AND REPRODUCIBILITY ARE GUIDES IN MAKING CRYSTALLIZATION EXPERIMENTS.
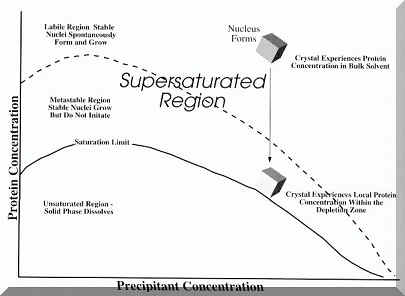
Krystalizace je proces sestávající z hledání individuálních podmínek a parametrů ovlivňujících vznik krystalů a jejich následné optimalizace vedoucí k získání kvalitních monokrystalů vhodných pro rentgenovou strukturní analýzu. Podstata krystalizace spočívá v pomalém přivedení systému do stavu snížené rozpustnosti a dosažení limitního stupně přesycení postupnou modifikací vlastností systému (teplota, pH, koncentrace jednotlivých komponent v roztoku, atd.)
Vznik krystalů ovlivňují mnohé termodynamické i kinetické faktory. Rozpustnost látky patří mezi faktory termodynamické, nukleace a následný růst krystalů jsou faktory kinetické. Růstem krystalů se rozumí fázová změna kapaliny resp. plynu na pevnou látku (precipitát, krystal). Nutnou podmínkou zmiňovaného procesu je jednak přesycení roztoku, výsledkem čehož je precipitace nebo vytvoření stabilních krystalických jader, a jednak teplotní gradient mající vliv na kondenzaci molekul z plynu nebo na kondenzaci kapaliny.
Proces tvorby krystalů se skládá ze tří fází – nukleace, růstu a ukončení růstu krystalů. V průběhu nukleace dochází ke vzájemnému kontaktu vhodně orientovaných molekul resp. iontů a po překročení limitu nasycení se začínají tvořit stabilní agregáty, vzniká precipitát nebo submikroskopická krystalická jádra. Druhá fáze označována jako růst krystalů je dynamický proces, kdy dochází k interakci vhodně orientovaných molekul nebo iontů s povrchem jádra a jejich uspořádání na tomto povrchu. Růst krystalů je ovlivňován difúzním (rychlost difúze molekul v oblasti růstu krystalů) a depozičním (rychlost odčerpání pevné fáze z roztoku) stupněm. V případě, kdy je depoziční stupeň nízký, nedochází ke tvorbě růstových center, růst krystalů je pomalý nebo žádný. Jestliže je depozice vysoká, vzniká velké množství drobných krystalických jader, krystaly rostou extremně rychle, jsou malé a defektní (kazy, dislokace). Ideální krystaly vznikají z malého množství stabilních krystalických jader, které rostou volnou rychlostí bez defektů. Růst krystalů je dále ovlivněn změnou fyzikálně-chemických podmínek. Obecně platí, že možnost růstu se zvyšuje se snižující teplotou, kdy je transfer molekul na povrch jádra zpomalený a růstový stupeň zvýšený. Působením vhodných intermolekulových interakcí dochází ke snížení mobility molekul, k jejich interakci a následné tvorbě a růstu krystalů.
Finální fáze se nazývá zastavení růstu krystalů. Malé krystaly mohou růst pomalu, následně zvětšovat svoje rozměry a poskytnout vhodné vzorky pro rentgenovou strukturní analýzu. Alternativně může vznikat velké množství drobných mikrokrystalů nebo naopak velké multikrystalické agregáty, jako například dendrity (větvičkovité útvary podobné sněhovým vločkám) či sferulity (tenké jehlinové útvary) nebo mohou vznikat hydrofobní olejovité agregáty. Přítomnost uvedených agregátů naznačuje, že i nepatrná modifikace experimentálních podmínek může vést ke vzniku monokrystalů vhodných pro strukturní měření. V opačném případě se mohou vytvořit nekrystalické gely, amorfní pudry nebo nedojde k žádné změně a roztok zůstane čirý.
Krystalizace proteinů, nukleových kyselin a virů [1] se od krystalizace nízkomolekulových látek liší především svojí obtížností a časovou náročností. Krystalizace biologických makromolekul je empirický proces založený na hledání vhodných fyzikálně-chemických podmínek (pH, T, c, Id, R, p, ...) a jejich následné optimalizaci vedoucí k produkci monokrystalů biomakromolekul. Obtížnost krystalizace biomakromolekul je dána jejich složitostí, labilitou a dynamickými vlastnostmi. Proteiny i nukleové kyseliny jsou vysoce senzitivní, nepatrná změna některé z podmínek může způsobit jejich denaturaci, degradaci nebo změnu vlastností, které jsou nutné pro úspěšnou krystalizaci. Z tohoto důvodu musí být proteiny v hydratované formě udržovány při konstantním pH a teplotě.
Krystaly makromolekul obsahují průměrně 50% rozpouštědla, většinou mají charakter gelu s mnoha intersticiálními prostory, kterými může proudit rozpouštědlo nebo difundovat malé molekuly. Mřížkové interakce (solné můstky, vodíkové vazby, hydrofobní interakce) udržují integritu krystalu a vysvětlují rozdíly mezi vlastnostmi a schopností krystalizace u malých molekul a biomakromolekul. Vysoká neuspořádanost, gelový charakter, vysoká senzitivita na změny teploty, pH, druh rozpouštědla či iontovou sílu, jsou hlavní příčinou slabých difrakčních vlastností krystalů makromolekul. Krystaly jsou křehké, slabým tlakem se rozpadají, na vzduchu hydratují, vykazují slabé optické vlastnosti. V průběhu expozice radiačního záření dochází k silnému poškození krystalů, proto je nutné provádět měření na difraktometrech s plošným detektorem resp. na vysokofrekvenčných zdrojích rentegenového záření, tzv. synchrotronech.
Krystalizace biomakromolekul je v principu shodná s krystalizací malých molekul; vyžaduje systematickou modifikaci parametrů roztoku, které mají vliv na rozpustnost proteinu a jsou důležité při hledání rovnováhy mezi amorfním precipitátem a tvorbou krystalu. Klasické metody krystalizace makromolekul jsou založeny na zvyšování úrovně nasycení roztoku použitím vhodného precipitačního činidla ((NH4)2SO4, PEG,…) a dále na modifikaci pH, teploty, koncentrace proteinu nebo typu rozpouštědla.
I když makromolekuly vykazují specifické fyzikálně-chemické vlastnosti a jejich interakce s rozpouštědlem jsou složité, metody krystalizace musí být aplikovány na širokou škálu podmínek směřujících ke zjištění optimálních stavů, kdy dochází ke vzniku krystalů. Jde o určení precipitačního bodu roztoku proteinu postupnou modifikací pH a koncentrace precipitantu (= precipitačního činidla), opakování procedury při různé teplotě a určení efektivity různých typů precipitačních činidel.
 |
|
| Obrázek 1. Fázový diagram popisující krystalizaci proteinů (převzato z knihy Crystallization of Biological Macromolecules od A. McPherson, 1999) |
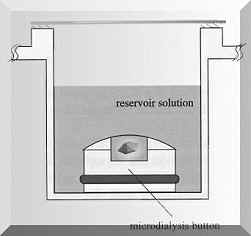
Obrázek 2. Dialýza v dialyzačním knoflíku (převzato z Hampton Research: Crystallization: Research Tools, Vol. 11, No. 1 (2001) 152-165) |
V současnosti existuje mnoho standardních krystalizačních technik, které se používají k určení potenciálních krystalizačních podmínek. Mezi nejpoužívanější patří dialýza (”dialysis”) a difúze (”vapor diffusion”). Podstata obou technik spočívá v kombinaci difúze par s použitím daných precipitantů, kdy je proteinový roztok přiveden do bodu nasycení regulovaným způsobem. Dialýza je metoda založená na difúzi malých molekul (ionty, aditiva, pufry, atd.) přes póry polopropustné membrány, která odděluje vnitřní roztok s proteinem od roztoku vnějšího (precipitant). Proudění malých molekul membránou způsobuje vytvoření koncentračního gradientu, tzv. oblast lokálního přesycení. Proteinový roztok zůstává a zakoncentrovává se ve vnitřním roztoku. Tímto způsobem může dojít k vytvoření krystalizačních jader, které dále rostou a formují krystaly. Rychlost dosažení rovnováhy závisí na typu použité membrány, na koncentračním gradientu mezi vnitřním a vnějším roztokem a na teplotě.
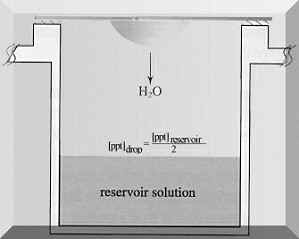
Jelikož rovnovážný stav, kdy za určitých podmínek dochází k vyloučení krystalů z rozpouštědla, je stav závislý na dosažení minimální povrchové energie pro daný objem krystalu, je nejefektivnější pracovat s malými kapkami. Molekuly nacházející se uvnitř kapky mají nižší energii než molekuly ležící na jejím povrchu. Za jistých podmínek může mít pevná fáze sklon k vyloučení se a v kapce vznikne krystal. Metody, při kterých se dosahuje přesycení v mikrokapkách, jsou založeny na difúzi par. Uvedená technika je založena na transportu vody resp. jiné těkavé látky mezi kapkou proteinu (objem 2-25 µl) obsahující pufr, precipitant, aditivum a velkým objemem roztoku v rezervoáru (objem 0,75-25 ml) sestávajícím ze stejných komponent jako kapka kromě roztoku proteinu. V důsledku rozdílné koncentrace roztoků v kapce a rezervoáru dochází vlivem vypařování těkavých látek (vody) provázenému kondenzací k vyrovnání osmolarity a ustálení rovnováhy. K uvedenému jevu dochází buď “destilací” vody z kapky do rezervoáru (matečný roztok v rezervoáru má vyšší koncentraci než kapka -> dochází ke změně objemu kapky a zakoncentrování všech jejich komponent) nebo naopak z rezervoáru do kapky. Migrace molekul závisí na koncentraci a rozpustnosti proteinu, koncentraci precipitačního činidla a případně vede ke vzniku krystalů. Krystalizace založena na difúzi par je aplikována pro kapky visící (”hanging drops”), sedící (”sitting drops”) a sendvičové (”sandwich drops”).
 |
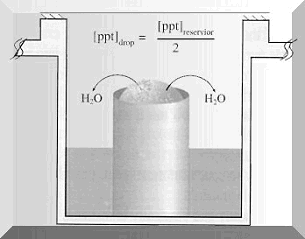 |
| Obrázek 3. Krystalizace ve visící a sedící kapce (převzato z Hampton Research: Crystallization: Research Tools, Vol. 11, No. 1 (2001) 152-165). | |
Mezi nejvíce používané a nejméně náročné metody patří krystalizace ve visící kapce. Při tomto způsobu krystalizace kapka “visí” na vnitřní straně mikroskopického krycího sklíčka umístěného nad rezervoárem s matečným roztokem. Sklíčko je k otvoru pro matečný roztok v krystalizační destičce připevněno a utěsněno pomocí silikonového tuku nebo viskózního oleje. Výhodou uvedené metody je především rychlost a jednoduchost jak v manipulaci a uskladnění, tak i v mikroskopickém pozorování. Princip metody sedící kapky spočívá v tom, že kapka “sedí” ve stojánku umístěném v otvoru krystalizační destičky pro matečný roztok. Těsnění je zabezpečeno silikonovým tukem nebo lepící páskou. I když metoda visící kapky patří mezi nejjednodušší, vyžaduje optimalizaci množství fyzikálních a chemických parametrů, důsledkem čehož se mohou počáteční zdlouhavé pokusy stát odrazujícími. Z tohoto důvodu je výhodné pro počáteční experimenty (tzv. screening krystalizačních podmínek) použít komerčně dostupné sady krystalizačních činidel (“screening kits”), které poskytují rychle hmatatelné ukazatele pro další krystalizace a odstraňují především časově náročnou přípravu mnoha krystalizačních roztoků.
Uvedené metody slouží jak k optimalizaci krystalizačních podmínek, tak i k samotnému pěstování krystalů pro difrakční měření.
Rozpustnost proteinu ve vodě závisí na jeho aminokyselinovém složení a na okolních faktorech, jakými jsou teplota, pH či přítomnost aditiv v roztoku. Jestliže koncentrace roztoku proteinu překročí limit rozpustnosti, roztok se stává přesyceným, molekuly proteinu se začínají shlukovat a protein přechází do separované nerozpustné fáze [6]. K tomuto jevu dochází ve dvou fázích označovaných jako nukleace a růst. V průběhu nukleace se molekuly proteinu seskupují do stabilního komplexu buď jako neuspořádaný amorfní precipitát a nebo jako krystaly. Ostatní molekuly proteinu jsou pak difúzí transportovány na povrch nukleačního komplexu a začíná tzv. růstová fáze.
Existuje velké množství faktorů, které ovlivňují růst krystalů; jejich přesná kompletizace však není možná z důvodu vysoké specificity jednotlivých proteinů (stačí, aby se proteiny lišily v jedné nebo malém počtu aminokyselin nebo byl identický protein připraven jiným způsobem nebo v jiném časovém rozpětí). Každý z níže uvedených faktorů (tabulka 1) může být více nebo méně důležitý pro daný protein. Jelikož jsou proteiny vysoce specifické biomakromolekuly, existuje pouze malé množství prostředků použitelných pro předpověď podmínek vedoucích k prospěšnému výzkumu. Různé parametry jsou na sobě nezávislé, ale jejich vzájemné vztahy mohou být komplikované a obtížně rozeznatelné. Neexistují směrnice popisující fyzikální faktory nebo chemickou podstatou matečných roztoků, jejichž aplikace by zvyšovala pravděpodobnost úspěchu krystalizace daného proteinu. Specifické podmínky a složení precipitačních roztoků musí být precizně dedukovány a upřesňovány pro každý protein individuálně.
|
Tabulka 1. Faktory ovlivňující růst krystalů makromolekul |
|||
|
1. |
pH a pufr |
13. |
tíha, proudění a sedimentace |
|
2. |
iontová síla (Id) a koncentrace (cM) a původ
precipitačního činidla |
14. |
Vibrace a zvuk |
|
3. |
teplota a teplotní změny |
15. |
objem krystalizačního vzorku |
|
4. |
koncentrace makromolekulárního roztoku (cp) |
16. |
Přítomnost amorfní nebo jiné látky |
|
5. |
čistota makromolekulárního roztoku |
17. |
tvar krystalizační nádobky |
|
6. |
aditiva, efektory, ligandy |
18. |
Proteolýza |
|
7. |
zdroje makromolekul – organismy |
19. |
Kontaminace mikroby |
|
8. |
substráty, koenzymy, inhibitory |
20. |
Tlak |
|
9. |
redukující nebo oxidující prostředí |
21. |
Elektrické a magnetické pole |
|
10. |
kovy a jiné specifické ionty |
22. |
lidský faktor – manipulace a čistota práce |
|
11. |
rychlost rovnováhy a růstu |
23. |
viskozita matečného roztoku |
|
12. |
povrchové faktory nebo detergenty |
24. |
heterogenní nebo epitaxiální nukleační činidla |
V současnosti jsou téměř všechny krystalizace prováděny na základě systematické modifikace faktorů ovlivňujících rozpustnost proteinu, které byly vybrány pro empiricky nalezené podmínky vhodné pro vznik krystalů. Amorfní precipitát má tendenci převládat, jestliže koncentrace proteinu vysoko překračuje limit nasycení nebo je tohoto limitu dosaženo rychlým způsobem.
Strategie krystalizace proto spočívá v pomalém přivedení roztoku proteinu do bodu nepatrně nad jeho limitem nasycení, kdy dochází ke vzniku malého množství krystalizačních jader, které volnou rychlostí pokračují v dalším růstu.
K nasycení roztoku může dojít buď zvýšením koncentrace proteinu nebo snížením jeho rozpustnosti. I když ke snížení rozpustnosti proteinu může dojít modifikací mnoha fyzikálních nebo chemických parametrů, ve většině případů se využívají precipitační činidla neboli precipitanty. Kombinace difúze par s použitím vhodného precipitantu je podstatou krystalizace v kapkách.
Mezi základní typy precipitantů, které se liší svojí funkcí působení, patří soli (např. (NH4)2SO4, NaCl, MgCl2) a organická rozpouštědla (z těkavých např. methanol, ethanol, terc-butanol, aceton; z netěkavých např. 2-methyl-2,4-pentandiol (MPD), glukosa; speciální kategorii organických precipitantů tvoří dlouhé polymerní látky, jako např. polyethylenglykol (PEG) s rozdílnou Mr, polypropylenglykol P400, karboxymethylcelulosa, atd.).
Soli jako precipitanty narušují hydratační vrstvu proteinů, zmenšují přitažlivé interakce protein-rozpouštědlo a zvyšují přitažlivé interakce protein-protein. Při intenzivní konkurenci iontů solí s proteinem dochází k dehydrataci nebo eliminaci a rozrušení vrstev kolem proteinových molekul (tím je indikována jejich nerozpustnost), ty se samy začínají seskupovat a separovat z roztoku. Agregáty mají charakter lineárních resp. větvených oligomerů nebo precipitátu (sraženiny). Tvorba 3-D agregátů se pokládá za vznik krystalizačních jader, které se mohou dále formovat a růst. Záměna druhu soli může mít vliv na rozmanitost kvality, morfologie a difrakčních vlastností krystalů. Funkce organických precipitantů spočívá ve snižování dielektrické konstanty roztoku, kdy dochází ke snížení elektrostatického stínění nabitých a polárních funkčních skupin na proteinech [7].
Výsledkem působení obou druhů precipitačních činidel je zvýšení přitažlivých sil mezi molekulami proteinu, které mohou vést ke krystalizaci. Obecně platí, že koncentrace precipitantu je pouze o malé procento nižší než ta, při které vzniká amorfní precipitát.
Některé specifické organické precipitanty nedenaturují proteiny a proto je jejich použití výhodnější. Do této skupiny precipitantů patří např. MPD nebo PEGy s různou molekulární hmotností (Mr se pohybuje od 200 do 20 000, nejčastěji se používají PEGy s Mr 2000 až 6000). Funkce polyethylenglykolu jako precipitantu je spojena s jeho schopností snižovat dielektrickou konstantu roztoku [8] (PEG narušuje původní strukturu rozpouštědla a vytváří komplexní síť z vody a vlastních molekul, čím dochází k redukci dielektrické konstanty). Výhodou použití PEGů je krystalizace proteinů při úzkém rozsahu koncentrací precipitantu (rozsah 4-18 %) a kratší krystalizační čas ve srovnání s jinými netěkavými precipitanty (soli, MPD). Jelikož jsou roztoky PEGů snadno kontaminovatelné (slouží jako vhodná média pro růst bakterií a plísní), je nutno pracovat pokaždé s čerstvě připravenými sterilními roztoky, nejlépe při nízkých teplotách. V případě, že se krystalizuje při laboratorní teplotě, přidává se k roztoku precipitantu 0.02-1% azid sodný jako mikrobiálně-retardační činidlo. NaN3 se nesmí přidávat do krystalizačních roztoků jestliže tyto obsahují ionty těžkých kovů, mohlo by totiž dojít ke vzniku explozivních solí azidů kovů [9].
Krystalizační experimenty s proteiny probíhají ve dvou stadiích. V první fázi je široký rozsah podmínek zužován testováním rozpustnosti proteinu s ohledem na precipitační činidlo a ostatní komponenty roztoku. V tomto stupni se nepředpokládá možnost získání krystalů vhodných pro difrakční měření. Může však být stanovena hranice mezi podmínkami, kdy je protein rozpustný a kdy naopak nerozpustný (obyčejně se nerozpustnost proteinu projevuje vznikem amorfního precipitátu). Stanovení precipitačních podmínek je prvním krokem k možnému růstu krystalů. Ve druhé fázi se podmínky, při kterých dochází ke tvorbě precipitátu, pomalu systematicky modifikují směrem k postupnému zvyšování nerozpustnosti požadované ke vzniku krystalizačních jader [10]. Počáteční experimenty se zpravidla provádějí s komerčně dostupnými sadami krystalizačních roztoků (dodávají např. firmy: Hampton Research, Laguna Niguel, CA, USA; JenaBioScience, GmbH, Jena, Německo; Molecular Dimensions Ltd., Soham, UK) nebo se používají tzv. matice (”sparse matrix screens”) [11], které jsou však dostupné pouze v omezeném množství a druhu. Jde o sady roztoků precipitant-pufr sloužící jako výchozí body pro krystalizační experimenty. Použití uvedených precipitačních roztoků vychází z poznatku, že nejlepší podmínky pro počáteční screening jsou ty, které se s úspěchem používají pro krystalizace jiných, zvláště pak strukturně podobných proteinů.
Ke krystalizačním experimentům založeným na difúzi par v kapkách se používají destičky s 24 otvory (např. ”VDX plates”, ”Limbro boxes”), jež poskytují snadnou manipulaci, uskladnění a experimentování. Silikonizovaná mikroskopická krycí sklíčka s kapkami vzorků jsou utěsněna nad jednotlivými otvory vakuovým lepidlem nebo vazelínou. Výhoda použití silikonizovaných sklíček spočívá v tom, že nedochází k tzv. rozlití kapky, důsledkem čehož by došlo k nerovnoměrnému vypařování. Silikonizovaná sklíčka jsou buď komerčně dostupná nebo se k jejich silikonizaci používá zředěný silikonový olej připravený z koncentrátu PROSIL-28 (Hampton Research, Laguna Niguel, CA, USA).
Předpokladem úspěšné krystalizace proteinu je především jeho čistota. Obecně platí: Čím čistější je protein, tím větší je šance že vykrystalizuje. V ideálním případě se protein krystalizuje ihned po jeho purifikaci. Tímto se často zabrání jeho strukturní degradaci oxidací, proteolýzou, atd. Před vlastní krystalizací se protein převede do promývacího pufru (jeho koncentrace je <= 5 mM) a v případě potřeby se zakoncentruje. Nejvhodnější koncentrace proteinu určeného ke krystalizačním experimentům by se měla pohybovat v rozmezí 5-30 mg/ml. Biologicky inertní tzv. Goodsovy pufry [12] často používané ke krystalizacím jsou uvedeny v tabulce 2.
|
Tabulka 2. Nejpoužívanější krystalizační pufry |
||
|
Pufr |
pKa |
rozsah pH |
|
Octan Citrát MES Imidazol HEPES Tris Bicin |
4.76 5.40 6.15 6.95 7.55 8.06 8.35 |
4.2 - 5.3 4.9 - 5.9 5.6 - 6.7 6.4 - 7.5 7.0 - 8.1 7.5 - 8.6 7.8 - 8.9 |
Pro krystalizaci v kapkách se používají destičky s 24 otvory (např. ”VDX plates”, ”Limbro boxes”) a krytem. Do jednotlivých otvorů se pipetuje daný precipitační roztok v objemu 0.5-1.0 ml. Kolem otvoru se nanese souvislá vrstvička těsnící látky (vakuové lepidlo, vazelína, silikonový olej). Doprostřed silikonizovaného krycího sklíčka se pipetuje 2.5 až 10 µl roztoku proteinu (na počáteční screening je vhodnější používat menší objemy, později z důvodu snahy získat větší krystaly se doporučuje pracovat s většími objemy roztoků). Ke kapce proteinu se přidá matečný roztok z rezervoáru (2.5 až 10 µl), celý objem kapky se nasaje do špičky pipety, čím dojde k promíchání a nová kapka se umístí nejlépe do středu sklíčka. Počet promíchání roztoků se opakuje v závislosti na jejich viskozitě (2-3x, resp. 5-10x u viskózních roztoků). Jestliže se v kapce vytvoří vzduchové bublinky, je nutné odstranit je nasátím pipetou. Krycí sklíčko s kapkou se pak umístí nad daný otvor v destičce a mírným tlakem se utěsní. Kompletní krystalizační destička se zakryje krytem, popíše a uloží na nerušené místo s minimální teplotní fluktuací (nejlépe do inkubátoru s přednastavenou konstantní teplotou). Doporučuje se provádět dva paralelní krystalizační experimenty, jeden při laboratorní teplotě a druhý při teplotě 4 °C.
Jelikož jsou proteinové krystaly vysoce nestabilní a mohou vznikat stejně rychle jako se rozpadat, je důležité je sledovat s určitou pravidelností. Zpočátku je vhodné pozorovat změny v kapkách každý den (nejméně po dobu jednoho týdne), později stačí jednou týdně. Na sledování experimentů a procesů uvnitř kapek se používají polarizační stereomikroskopy nejlépe se studeným zdrojem osvětlení. Manipulace s destičkami vyžaduje opatrnost, aby se zabránilo otřesům nebo ztrátě kapky pádem do rezervoáru.
Proteinové roztoky používané ke krystalizacím by neměly obsahovat žádné proteinové agregáty, měly by být transparentní s mírně namodralým nádechem. Smícháním roztoku proteinu s precipitantem dochází v kapkách v průběhu několika minut či hodin buď ke vzniku amorfního precipitátu, bílého až našedlého zákalu nebo kapky zůstávají čiré a precipitát se nevytvoří ani v průběhu několika dní. V některých případech rostou mikrokrystaly na pozadí amorfního precipitátu. Tehdy stačí malá modifikace krystalizačních podmínek vedoucí ke vzniku samostatných krystalů nebo se mikrokrystaly dají použít k očkování. Monokrystaly jsou transparentní útvary daného tvaru popsaného planárními plochami a úhly mezi nimi. Proteinové krystaly jsou často schopné v rovině polarizovaného světla měnit svoje zabarvení ze světlého na tmavé a naopak.
Zkušenosti a reprodukovatelnost jsou základními vodítky sloužícími k identifikaci krystalů. Pufry používané ke krystalizacím jsou obyčejně málo koncentrované, nemělo by tedy docházet k jejich krystalizaci. Je známo, že některé soli, jako např. síran amonný nebo fosforečnan draselnosodný, používané ve vyšších koncentracích, mohou krystalizovat namísto proteinů. Ke krystalizacím solí dochází zvláště tehdy, když jsou soli míchány společně s precipitačními iontovými pufry (pufry s
Ca2+) nebo organickými molekulami, které mohou pozměnit rozpustnost jednotlivých složek roztoku určeného ke krystalizování. V mnoha případech však krystaly solí vznikají a rostou rychle, na rozdíl od krystalů proteinů, které rostou několik dnů, týdnů i měsíců. Existuje několik metod, na jejichž základě je možné testovat krystaly. Jedná se většinou o metody destruktivní, proto je možné je použít pouze v případech, kdy máme více krystalů. V tabulce 3 jsou tyto metody seřazeny podle vzrůstající spolehlivosti.
|
Tabulka 3. Testy používané k rozlišení krystalů proteinů × krystalů anorganických/organických molekul |
|||
|
Test |
Postup
|
Pozorování |
|
|
krystaly proteinu |
krystaly soli |
||
|
Test drcením (”Crush test”) |
krycí sklíčko s krystalem se opatrně umístí pod
stereomikroskop a krystal se rozbije skleněnou kapilárkou |
už při slabém nárazu se rozpadnou na spoustu malých kusů |
drtí se těžko a rozpadají se na málo větších kusů |
|
Dehydratační test (”Dehydration test”) |
krystal se pomocí kapiláry vyjme z kapky a ponechá na vzduchu |
na vzduchu se po krátké době rozkládají |
zůstávají neporušené |
|
Barvící
test |
do kapky se přidá barvivo ”Izit” (Hampton Research) |
zabarví se modře |
barvivem se nezbarví |
|
Gelová elektroforéza (”Gel electrophoresis”) |
analýza rozpuštěných krystalů pomocí SDS-PAGE |
na gelu je pozorovatelná i kvantita proteinu |
|
|
Rtg. difrakční analýza (”X-ray diffraction”) |
definitivní test, kterým jsou krystaly proteinu spolehlivě rozpoznány
od krystalů solí podle naměřených charakteristik |
||
Počáteční krystalizační experimenty důležité k získání informací o vhodných podmínkách krystalizace poskytují tři možné výsledky. Při jistých podmínkách, jež jsou dány použitím jistých druhů precipitačních činidel, je v kapkách možno pozorovat:
1. mikrokrystaly až monokrystaly proteinu (ideální případ)
2. amorfní precipitát resp. krystalické agregáty (nutná optimalizace podmínek krystalizace)
3. žádnou změnu, kapka je čirá (nové hledání podmínek krystalizace)
V prvních dvou případech jsou krystaly buď přímo použitelné pro difrakční analýzu nebo stačí jemně optimalizovat podmínky, kdy se místo precipitátu v kapkách vytvoří mikrokrystaly, které mohou dále sloužit k očkování, výsledkem čehož jsou pak měřitelné monokrystaly. V posledním případě je nutná systematická optimalizace každé z použitých podmínek modifikací pH a koncentrace jednotlivých komponent roztoku. Krystalizace proteinů tedy vyžaduje systematickou modifikaci parametrů směřujících k nalezení rovnováhy mezi amorfním precipitátem a krystalem. Nejdůležitější faktory optimalizační strategie jsou uvedeny v tabulce 4.
Tabulka 4. Stručná charakteristika nejvýznamnějších faktorů ovlivňujících průběh krystalizace
|
pH a pufr |
Pufry používané na purifikaci proteinu jsou obyčejně vhodné i pro vlastní krystalizaci s ohledem na požadovaný rozsah pH. Koncentrace pufrů se pohybuje v rozsahu 50-200 mM. Většina proteinových krystalů popisovaných v literatuře roste při pH 7.0, ale jsou známé proteiny, jejichž krystaly rostou při extremních hodnotách pH, pod 5.0 resp. nad 9.0. To je důvod, proč se při počátečních experimentech používá široký rozsah pH (od 4.0 do 9.0) pro zvolenou kombinaci roztoků protein-precipitant. V mnoha případech pak minimální změna pH může vést k úspěšné krystalizaci (rozdíly mezi amorfním precipitátem, mikrokrystaly a monokrystaly jsou pozorovatelné při změně pH < 0.5 [13]. Hodnoty pH se nastavují pomocí kyselin nebo zásad (HCl, NaOH,...). |
|
teplota |
Téměř 1400 makromolekul bylo vykrystalizováno v teplotním rozsahu 0-4°C, nejméně 800 pak při pokojové teplotě (20-24°C). Proteiny jsou při nižší teplotě méně rozpustné a stabilnější a nízká teplota napomáhá uchovat jejich vlastnosti v průběhu delšího krystalizačního období. Pomalejší změna rozpustnosti proteinu při nízké teplotě vyžaduje delší čas k formování krystalizačních jader. Bylo zjištěno, že protein i precipitant jsou koncentrovány 3 až 5x rychleji při 20°C než při 4°C [14]. I přesto se krystalizace často provádějí při teplotě pokojové, kdy nedochází ke komplikacím způsobeným změnami pH v důsledku teplotních rozdílů. |
|
koncentrace proteinu a precipitačního činidla |
Počas krystalizace v důsledku vypařování vody a její kondenzace do rezervoáru dochází v kapce k pomalému zvyšování koncentrace proteinu a precipitantu. Po dosažení rovnováhy se objem kapky postupně zmenší o 25-50%. V praxi se používá proteinový roztok zakoncentrovaný na nejvyšší možnou hodnotu. Nejvhodnější koncentrace roztoku proteinu by měla být v rozmezí 5 až 30 mg/ml, ale jsou známé i proteiny krystalizující z roztoku o koncentraci pod 1 mg/ml nebo nad 100 mg/ml. Koncentrace precipitantů jsou proměnlivé s ohledem na precipitaci proteinu. Někdy je výhodné měnit koncentraci proteinu podle koncentrace precipitantů, např. když nízké koncentrace precipitačních činidel vedou k precipitaci proteinu nebo vznikají kazové krystaly. Snížení koncentrace proteinu pod optimální limit vede k růstu drobných krystalů. |
|
ligandy a jiné komponenty |
Ionty kovů, nukleotidy, peptidy, enzymy, detergenty, kofaktory atd. hrají
důležitou roli v krystalizačních experimentech. Redukční činidla
(např. glutathion, 2-merkaptoethanol) jsou vhodné k prevenci SH skupin
a zabraňují oxidaci. NaN3 a thymol se používají jako
antibakteriální a antimykotická činidla. Ionty kovů mají vliv na
aktivitu proteinů, mohou stimulovat jejich růst. Substráty, koenzymy
a inhibitory se často používají k fixaci proteinu do kompaktnější
a stabilnější formy. Ligandy
a kofaktory mohou vykazovat efekty ovlivňující strukturu proteinů a
jejich schopnost krystalizovat. Krystalizovatelnost proteinů mohou dále
pozitivně ovlivnit např. detergenty (dodecyl-b-D-maltosid, 1-octyl-b-D-thioglucosid, atd.), činidla zlepšující rozpustnost proteinů (např. močovina,
SCN-, I-, NO3- ionty) nebo jiná
stabilizační činidla [15, 16], jejichž malý přídavek
do matečného roztoku zabrání buď vzniku nespecifických agregátů
či olejovitého precipitátu vznikajícího v důsledku hydrofobních
interakcí mezi molekulami nebo zvýší rozpustnost proteinů (membránové,
lipofilní, proteiny s omezenou rozpustností ve vodě) ve vodě, a tím
napomůže růstu krystalů. |
Očkování [17, 18, 19] se používá v případech a) kdy prvotní krystalizační experimenty vedou ke vzniku krystalického precipitátu, mikrokrystalů resp. porušených krystalů nebo b) při pokusech krystalizovat protein z podobných roztoků za předpokladu zachování identických krystalizačních podmínek.
Očkování je výhodné jak pro zmapování krystalizačních podmínek vedoucích k získání prvních krystalů, tak i pro optimalizaci těchto podmínek směřujících k získání větších a kvalitnějších krystalů. Z důvodu zabránění zdlouhavého vyhledávání podmínek se používá metoda ”cross-seeding” (očkování příbuzným krystalem), kdy se jako krystalizační zárodky použijí krystaly příbuzné molekuly o které je známo, že krystalizuje. Tato metoda je vhodná pro proteiny získané z předem vykrystalizované látky pomocí genetických nebo molekulárních úprav. Jinou metodou, která používá již předem narostlé krystaly a která směruje k rychlému a efektivnímu nalezení široké škály růstových podmínek je tzv. ”streak seeding” (vlasové očkování). Při této metodě se pracuje s vláknem (např. vlas nebo kočičí chlup) upevněným v kapiláře, na kterém se zachycená krystalizační zrnka přenesou do předekvilibrovaného* proteinového roztoku tak, že se v kapce tahem vytvoří čára, podél které pak rostou krystaly proteinu.
Další metody používané k produkci větších krystalů s dobrým stupněm reprodukovatelnosti jsou nazývány ”microseeding” a ”macroseeding”. Uvedené očkovací techniky se liší tím, že jedna jako krystalizační zárodky (“seeds”) používá mikrokrystaly neboli očkovací roztok (“seed stock”)*, ve druhé se na očkování používají krystaly větší, tzv. makrozrna (krystal opláchnutý ve stabilizačním roztoku se přenese do předekvilibrované proteinové kapky a v optimálním případě je možno po několika dnech pozorovat jeho nárůst). V literatuře obě metody detailně popisují Fitzgerald [20] nebo Thaller [21].
Aplikace očkovacích metod je vhodná k opětovnému získání již dříve narostlých krystalů proteinů při podmínkách, kdy je buď formování krystalizačních jader limitováno nebo spontánní nukleace probíhá při takové úrovni přesycení, kdy rostou nekvalitní krystaly. V těchto případech je vhodné navodit růst krystalů řízeným způsobem při nižší úrovni přesycení roztoku, např. pomocí očkování nestabilního přesyceného proteinového roztoku krystaly z předešlých experimentů. Podle způsobu provedení se očkování rozděluje na homogenní a heterogenní. Stručná charakterizace jednotlivých typů očkování je uvedena v tabulce 5.
|
Tabulka 5. Popis jednotlivých očkovacích metod |
||
|
Typ očkování |
Název metody |
Stručná charakteristika metody |
|
|
”microseeding” |
Mikroskopické
krystalické fragmenty se vkládají do připraveného předekvilibrovaného
proteinového roztoku |
|
”macroseeding” |
Opláchnuté
proteinové krystaly jsou jednotlivě vkládány do předekvilibrovaného
roztoku proteinu |
|
|
Heterogenní |
”cross-seeding” |
forma
očkování, kdy očkovací zrna (jako zárodky) pocházejí z podobného
proteinu resp. proteinového komplexu |
|
”epitaxial nucleation” (epitaxiální nukleace) |
vhodný povrch navozuje růst nových 3D krystalů, např. nukleace
proteinových krystalů na vlákně celulosy, které je v proteinovém
roztoku přítomné jako nečistota |
|
*Pozn.
1. Předekvilibrovaný roztok je roztok připravený za stejných resp. mírně změněných podmínek známých z dřívějších krystalizačních experimentů. Zredukování koncentrace precipitantu se určuje experimentálně podle doby ekvilibrace kapek, která je obyčejně 1-5 dní. Předekvilibrovaný proteinový roztok se používá z důvodu zabránění rozpuštění zrnek krystalů po jejich přenosu do nové kapky.
2. ”Seed stock” se připravuje oplachováním tří či čtyř malých krystalů ve stabilizačním roztoku (roztok z rezervoáru), krystaly jsou pak přeneseny do 24-hodin předekvilibrovaného roztoku a rozdrceny; před vlastní krystalizací se roztok vhodně zředí.
Vhodně uskladněné krystaly proteinů jsou schopny difraktovat i po několika letech. Při manipulaci s krystaly je nutno dbát vysoké opatrnosti. Krystaly proteinů mohou být ponechány v kapkách, ve kterých narostly, nebo se mohou zmrazit a uchovávat v tekutém dusíku. Kapky s krystaly musí být uchovány ve tmě, neboť světlo podněcuje volné radikálové řetězové reakce, které v konečném důsledku mohou krystal poškodit nebo i zničit.
1. Glusker, J. P., Lewis, M. and Rossi, M.: Crystal Structure Analysis for Chemist and Biologist. VCH Publishers Inc., New York, 1994
2. Bolag, D. M. et al.: Protein Methods. Wiley-Liss Inc., New York 1996
3. McPherson, A.: Crystallization of Biological Macromolecules. CSHL Press, New York 1999
4. McPherson, A., Malkin, A. J. and Kuznetsov, Y. G.: Structure 3, 759-768, 1995
5. Arakawa, T. and Timasheff, S. N.: Meth. Enzymol. 114, 49-77, 1985
6. McPherson, A.: Meth. Enzymol. 114, 112-120, 1985
7. McPherson, A.: Meth. Enzymol. 114, 120-125, 1985
8. Rozycki, M. and Bartha, R.: Appl. Env. Microbiol. 41, 833-836, 1981
9. Cudney, B., Patel, S., Weisgraber, K., Newhouse, Y. and McPherson, A.: Acta Cryst.
D50, 414-423, 1994
10. Jancarik, J. and Kim, S. H.: J. Appl. Cryst. 24, 409-411, 1991
11. Good, N. E., Winget, G. D., Winter, W., Connolly, T. N., Izana, K. M. and Singh, R. M.
M.: Biochemistry 5, 467-477, 1966
12. Zeppenzauer, M.: Methods Enzymol. 22, 253, 1971
13. Mikol, V., Rodeau, J.-L. and Giegé, R.: Anal. Biochem. 186, 332-339, 1990
14. McPherson, A., Koszelak, S., Axelrod, H., Day, J., Williams, R., Robinson, L., McGrath, M. and Cascio, D.:
J. Biol. Chem. 261, 1969-1975, 1986
15. Sousa, R.: Acta Cryst. D51, 271-277, 1995
16. Stura, E. A. and Wilson, I. A.: J. Crystal Growth 110, 270, 1991
17. Stura, E. A. and Wilson, I. A.: Methods, A Companion to Methods in Enzymology 1, 38, 1990
18. Lambert, G., Stura, E. A. and Wilson, I. A.: J. Biol. Chem. 264, 12730, 1989
19. Fitzgerald, P. M. D. and Madsen, N. B. J.: J. Crystal Growth 76, 600, 1987
20. Thaller, C., Eicher, G., Weaver, L. H., Wilson, E., Karlsson, R. and Jansonius, J. N.:
Methods Enzymol. 115, 132-135, 1985
21. McRee, D. E.: Practical Protein Crystallography, Academic Press Inc., California, 1993